题目内容
9.已知某酸H2B在水溶液中存在下列关系:①H2B?H++HB-,②HB-?H++B2-.关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是( )| A. | NaHB属于弱电解质 | |
| B. | 溶液中的离子浓度c(Na+)>c(HB-)>c(H+)>c(OH-) | |
| C. | NaHB和NaOH溶液反应的离子方程式为H++OH-═H2O | |
| D. | c(Na+)=c(HB-)+c(B2-)+c(H2B) |
分析 A.NaHB属于离子化合物,且在溶液中完全电离,属于强电解质;
B.溶液酸碱性取决于HB-的电离程度与水解程度大小,所以NaHB溶液可能为酸性溶液,也可能显示碱性;
C.H2B为弱电解质,HB-不能拆开,离子方程式中应该写成整体;
D.溶液中一定满足物料守恒,根据NaHB溶液中的物料守恒判断.
解答 解:A.NaHB为离子化合物,在溶液中完全电离出钠离子和HB-,所以NaHB一定为强电解质,故A错误;
B.由于没有告诉NaHB溶液的酸碱性,无法判断HB-的电离程度与水解程度大小,无法判断溶液中各离子浓度大小,故B错误;
C.HB-不能拆开,NaHB和NaOH溶液反应正确的离子方程式为:HB-+OH-=H2O+B2-,故C错误;
D.根据NaHB溶液中的物料守恒可得:c(Na+)=c(HB-)+c(B2-)+c(H2B),故D正确;
故选D.
点评 本题考查了溶液中离子浓度大小比较,题目难度中等,注意掌握强弱电解质的概念及判断方法,能够根据电荷守恒、物料守恒、盐的水解原理判断溶液中各离子浓度大小.

练习册系列答案
相关题目
20.一定条件下,将A、B、C三种物质各1mol通入一个密闭容器中发生反应:2A+B?2C,达到化学反应限度时,B的物质的量可能是( )
| A. | 1.5 mol | B. | 1 mol | C. | 0.5 mol | D. | 0 |
4.在一定的温度下,向CH3COONa的稀溶液里加水稀释,下列各种量变小的是( )
①H+的物质的量浓度
②OH-的物质的量浓度
③c(CH3COO-)/c(CH3COOH)
④c(H+)•c(OH-)
①H+的物质的量浓度
②OH-的物质的量浓度
③c(CH3COO-)/c(CH3COOH)
④c(H+)•c(OH-)
| A. | ①② | B. | ② | C. | ②③ | D. | ②③④ |
14.下列关于晶体的说法正确的是( )
| A. | 熔化二氧化硅和金刚石时所克服的粒子间的作用力类型同种 | |
| B. | 原子晶体的熔点一定比金属的高 | |
| C. | 构成分子晶体的微粒一定含有共价键 | |
| D. | 晶体中只要有阳离子就一定有阴离子 |
1. 是对甲基苯乙醛的键线式,由它转化为对甲基苯乙炔(
是对甲基苯乙醛的键线式,由它转化为对甲基苯乙炔(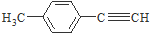 )的一条路线如下:
)的一条路线如下:
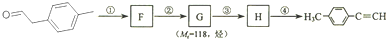
(1)对甲基苯乙醛的分子式为:C9H10O;
(2)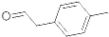 分子中一定在同一平面的原子数为12个;
分子中一定在同一平面的原子数为12个;
 分子中在同一直线上的原子数最多有6个;
分子中在同一直线上的原子数最多有6个;
(3)写出①--④步反应所加试剂、反应条件和①--③步反应类型:
 是对甲基苯乙醛的键线式,由它转化为对甲基苯乙炔(
是对甲基苯乙醛的键线式,由它转化为对甲基苯乙炔( )的一条路线如下:
)的一条路线如下:
(1)对甲基苯乙醛的分子式为:C9H10O;
(2)
 分子中一定在同一平面的原子数为12个;
分子中一定在同一平面的原子数为12个; 分子中在同一直线上的原子数最多有6个;
分子中在同一直线上的原子数最多有6个;(3)写出①--④步反应所加试剂、反应条件和①--③步反应类型:
| 序号 | 所加试剂及反应条件 | 反应类型 |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
18.下列各组物质的晶体中,晶体类型相同,化学键类型也完全相同的是( )
| A. | CO2和SiO2 | B. | CCl4和Fe | C. | CaCl2和HCl | D. | SO3和SO2 |
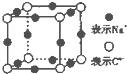 A、B、C、D、E、F、G是原子序数依次增大的七种元素,其中A~F为短周期主族元素,G为第四周期元素.已知:A是原子半径最小的元素,B和D同周期,固态的BD2能升华,E、F在B、D的下一周期,且E原子的最外层电子数与次外层电子数之比为3:4;G的质子数比F多12.请回答:
A、B、C、D、E、F、G是原子序数依次增大的七种元素,其中A~F为短周期主族元素,G为第四周期元素.已知:A是原子半径最小的元素,B和D同周期,固态的BD2能升华,E、F在B、D的下一周期,且E原子的最外层电子数与次外层电子数之比为3:4;G的质子数比F多12.请回答: ,NH4Cl的电子式
,NH4Cl的电子式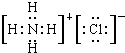 ;
;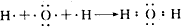 ;
; 病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题:
病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题: