题目内容
16.下列操作达不到预期目的是( )①石油分馏时把温度计插入受热的液体中
②用酸性高锰酸钾溶液除去乙炔中含有的H2S
③用乙醇和63%的硫酸共热到170℃制取乙烯
④将苯和溴水混合后加入铁粉制取溴苯
⑤将敞口久置的电石与蒸馏水混合制乙炔.
| A. | 只有②③④⑤ | B. | 只有①③④⑤ | C. | ①②③④⑤ | D. | 只有①②③⑤ |
分析 ①石油分馏时把温度计测量馏分温度;
②酸性高锰酸钾溶液和乙炔、H2S都发生氧化还原反应;
③用乙醇和98%的硫酸共热到170℃制取乙烯;
④将苯和溴混合后加入铁粉制取溴苯;
⑤将敞口久置的电石与蒸馏水混合制乙炔时不能收集到乙炔.
解答 解:①石油分馏时把温度计测量馏分温度,所以温度计水银球位于蒸馏烧瓶支管口处,故错误;
②酸性高锰酸钾溶液和乙炔、H2S都发生氧化还原反应,所以不能用酸性高锰酸钾溶液除去乙炔中的硫化氢,可以用碱溶液除去硫化氢,故错误;
③用乙醇和98%的硫酸共热到170℃制取乙烯,不能用稀硫酸,故错误;
④将苯和溴混合后加入铁粉制取溴苯,苯和溴水不反应,故错误;
⑤将敞口久置的电石与蒸馏水混合制乙炔时,因为敞口所以不能收集到乙炔,故错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及除杂、气体的收集、气体的制备、实验操作等知识点,明确实验原理是解本题关键,注意从实验操作的规范性及评价性进行分析判断,易错选项是④.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.某元素二价阴离子的核外有18个电子,质量数为34,该元素的原子核中的中子数为( )
| A. | 16 | B. | 18 | C. | 20 | D. | 22 |
4.在一定的温度下,向CH3COONa的稀溶液里加水稀释,下列各种量变小的是( )
①H+的物质的量浓度
②OH-的物质的量浓度
③c(CH3COO-)/c(CH3COOH)
④c(H+)•c(OH-)
①H+的物质的量浓度
②OH-的物质的量浓度
③c(CH3COO-)/c(CH3COOH)
④c(H+)•c(OH-)
| A. | ①② | B. | ② | C. | ②③ | D. | ②③④ |
11.下列叙述中,正确的是( )
| A. | 在一个基态多电子的原子中,可以有两个运动状态完全相同的电子 | |
| B. | 在一个基态多电子的原子中,不可能有两个能量完全相同的电子 | |
| C. | 在一个基态多电子的原子中,M层上的电子能量肯定比N层上的电子能量低 | |
| D. | 在一个基态多电子的原子中,如果某一能级上有多个未成对电子,它们自旋方向必然相同 |
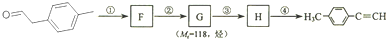
1. 是对甲基苯乙醛的键线式,由它转化为对甲基苯乙炔(
是对甲基苯乙醛的键线式,由它转化为对甲基苯乙炔(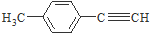 )的一条路线如下:
)的一条路线如下:
(1)对甲基苯乙醛的分子式为:C9H10O;
(2)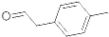 分子中一定在同一平面的原子数为12个;
分子中一定在同一平面的原子数为12个;
 分子中在同一直线上的原子数最多有6个;
分子中在同一直线上的原子数最多有6个;
(3)写出①--④步反应所加试剂、反应条件和①--③步反应类型:
 是对甲基苯乙醛的键线式,由它转化为对甲基苯乙炔(
是对甲基苯乙醛的键线式,由它转化为对甲基苯乙炔( )的一条路线如下:
)的一条路线如下:
(1)对甲基苯乙醛的分子式为:C9H10O;
(2)
 分子中一定在同一平面的原子数为12个;
分子中一定在同一平面的原子数为12个; 分子中在同一直线上的原子数最多有6个;
分子中在同一直线上的原子数最多有6个;(3)写出①--④步反应所加试剂、反应条件和①--③步反应类型:
| 序号 | 所加试剂及反应条件 | 反应类型 |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
5.图是元素周期表的一部分,试用化学符号回答下列问题:
(1)在这些元素中,单质的化学性质最不活泼的是Ar(填具体元素符号),其原子结构示意图为 .
.
(2)在这些元素中,③的气态氢化物与⑧的气态氢化物反应的现象为冒白烟,产物的晶体类型为离子晶体.
(3)在这些元素形成的最高价氧化物的水化物中,碱性最强的化合物的电子式为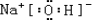 .
.
(4)⑥的单质与②、④形成的某种化合物反应的化学方程式为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(5)在⑦、⑧两种元素中,非金属性较强的是Cl(填具体元素符号),能证明这一结论的化学方程式为Cl2+H2S=2HCl+S.
(6)科学家借助元素周期表研究合成有特定性质的新物质,如在金属与非金属交界处寻找半导体材料.
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VIIA | 0族 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
 .
.(2)在这些元素中,③的气态氢化物与⑧的气态氢化物反应的现象为冒白烟,产物的晶体类型为离子晶体.
(3)在这些元素形成的最高价氧化物的水化物中,碱性最强的化合物的电子式为
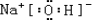 .
.(4)⑥的单质与②、④形成的某种化合物反应的化学方程式为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(5)在⑦、⑧两种元素中,非金属性较强的是Cl(填具体元素符号),能证明这一结论的化学方程式为Cl2+H2S=2HCl+S.
(6)科学家借助元素周期表研究合成有特定性质的新物质,如在金属与非金属交界处寻找半导体材料.
18.同一周期三种非金属元素X、Y、Z,其最高价氧化物的水化物的酸性由强到弱的顺序是:HXO4>H2YO4>H3ZO4.下列说法正确的是( )
| A. | 元素的非金属性:X<Y<Z | B. | X、Y、Z依次位于ⅤA族、ⅥA族、ⅦA族 | ||
| C. | 阴离子的还原性:X->Y2->Z3- | D. | 气态氢化物的稳定性:HX>H2Y>ZH3 |
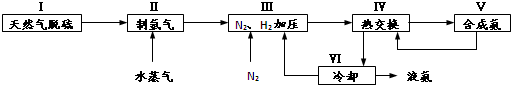
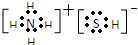 ,写出再生反应的化学方程式:2NH4HS+O2=2S↓+2NH3•H2O.NH3的沸点高于H2S,是因为NH3分子之间存在着一种比分子间作用力更强的作用力.
,写出再生反应的化学方程式:2NH4HS+O2=2S↓+2NH3•H2O.NH3的沸点高于H2S,是因为NH3分子之间存在着一种比分子间作用力更强的作用力.
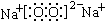 .
.