题目内容
14.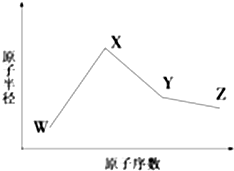 W、X、Y、Z、M、N是六种常见的短周期元素,其中W、X、Y、Z原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.M的原子序数比Y小1,N元素最高化合价是最低化合价绝对值的3倍.
W、X、Y、Z、M、N是六种常见的短周期元素,其中W、X、Y、Z原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.M的原子序数比Y小1,N元素最高化合价是最低化合价绝对值的3倍.(1)Y位于元素周期表中第三周期ⅣA族;
Z的最高价氧化物的水化物化学式为HClO4(写化学式)
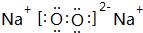
(2)加热条件下X单质与W单质生成的化合物的电子式为
 ,
,(3)X、M的最高价氧化物对应水化物相互反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(4)N的常见低价氧化物与Z单质的水溶液反应的化学方程式SO2+Cl2+2H2O=2HCl+H2SO4.
(5)M与Z形成化合物的化学式是AlCl3.实验测得当此化合物处于固态和熔融状态时不导电,溶于水能导电.由此判断该化合物是共价化合物 (填“离子”或“共价”).
分析 W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为18,中子数为10,则其质子数为18-10=8,故W为O元素;X和Ne原子的核外电子数相差1,且原子半径大于氧,所以X为Na元素;Y的单质是一种常见的半导体材料,原子序数大于Na,故Y为Si;Z的非金属性在同周期主族元素中最强,则Z为第ⅤⅡA族元素,原子序数大于Si,所以Z为Cl元素;M的原子序数比Y(Si)小1,则M为Al;N元素最高化合价是最低化合价绝对值的3倍,处于ⅥA族,则N为S元素,据此解答.
解答 解:W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为18,中子数为10,则其质子数为18-10=8,故W为O元素;X和Ne原子的核外电子数相差1,且原子半径大于氧,所以X为Na元素;Y的单质是一种常见的半导体材料,原子序数大于Na,故Y为Si;Z的非金属性在同周期主族元素中最强,则Z为第ⅤⅡA族元素,原子序数大于Si,所以Z为Cl元素;M的原子序数比Y(Si)小1,则M为Al;N元素最高化合价是最低化合价绝对值的3倍,处于ⅥA族,则N为S元素.
(1)Y为Si,位于元素周期表中第三周期ⅣA族;Z为Cl元素,最高价氧化物的水化物化学式为HClO4,
故答案为:第三周期ⅣA族;HClO4;
(2)加热条件下Na单质与氧气反应生成Na2O2,其电子式为 ,
,
故答案为: ;
;
(3)X、M的最高价氧化物对应水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)N的常见低价氧化物为SO2,与氯水反应生成HCl与H2SO4,Z反应的化学方程式为:SO2+Cl2+2H2O=2HCl+H2SO4,
故答案为:SO2+Cl2+2H2O=2HCl+H2SO4;
(5)M与Z形成化合物的化学式是AlCl3 ,实验测得当此化合物处于固态和熔融状态时不导电,溶于水能导电,由此判断该化合物是共价化合物,
故答案为:AlCl3;共价.
点评 本题考查位置结构性质关系应用,侧重对化学用语的考查,有利于学生对基础知识的巩固,难度不大.

 活力课时同步练习册系列答案
活力课时同步练习册系列答案①离子键 ②氢键 ③共价键 ④极性键 ⑤非极性键.
| A. | ①④ | B. | ①②④ | C. | ③⑤ | D. | ①③⑤ |
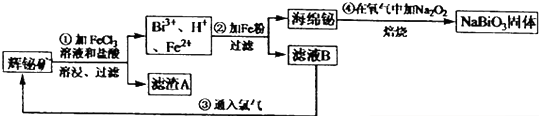
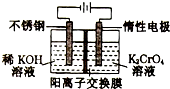 以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如下,下列说法不正确的是( )
以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如下,下列说法不正确的是( )| A. | 在阳极室,通电后溶液逐渐由黄色变为橙色 | |
| B. | 在阴极室,发生的电极反应为:2H2O+2e-═2OH-+H2↑ | |
| C. | 若测得右室中K与Cr的物质的量之比($\frac{nk}{ncr}$)为3:2,则此过程电路中共转移电子数为0.1NA | |
| D. | 若测定阳极液中K与Cr的物质的量之比($\frac{nk}{ncr}$)为d,则此时铬酸钾的转化率为2-d |
| A. | 在某反应中,当反应物具有的总能量大于生成物具有的总能量时,该反应吸热 | |
| B. | 同温同压下,4Al(s)+3O2(g)═2Al2O3(s)在常温和点燃条件下的△H不同 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l);△H=-53.7KJ/mol,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量大于53.7kJ | |
| D. | 需要加热的化学反应一定是吸热反应 |
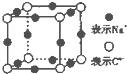 A、B、C、D、E、F、G是原子序数依次增大的七种元素,其中A~F为短周期主族元素,G为第四周期元素.已知:A是原子半径最小的元素,B和D同周期,固态的BD2能升华,E、F在B、D的下一周期,且E原子的最外层电子数与次外层电子数之比为3:4;G的质子数比F多12.请回答:
A、B、C、D、E、F、G是原子序数依次增大的七种元素,其中A~F为短周期主族元素,G为第四周期元素.已知:A是原子半径最小的元素,B和D同周期,固态的BD2能升华,E、F在B、D的下一周期,且E原子的最外层电子数与次外层电子数之比为3:4;G的质子数比F多12.请回答:
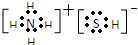 ,写出再生反应的化学方程式:2NH4HS+O2=2S↓+2NH3•H2O.NH3的沸点高于H2S,是因为NH3分子之间存在着一种比分子间作用力更强的作用力.
,写出再生反应的化学方程式:2NH4HS+O2=2S↓+2NH3•H2O.NH3的沸点高于H2S,是因为NH3分子之间存在着一种比分子间作用力更强的作用力.