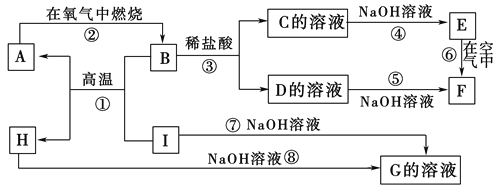
��Ŀ����
����Ŀ��100��ʱ����1 L���º��ݵ��ܱ������У�ͨ��0.1molN2O4��������Ӧ��N2O4(g)![]() 2NO2(g) ��H=+57.0kJ��mol-1��NO2��N2O4��Ũ����ʱ��仯�����ͼ��ʾ��
2NO2(g) ��H=+57.0kJ��mol-1��NO2��N2O4��Ũ����ʱ��仯�����ͼ��ʾ��

��.��1����0~60 s�ڣ���N2O4��ʾ��ƽ����Ӧ����Ϊ____mol��L-1��s-1��
��2������ͼ���й����ݣ�����100��ʱ�÷�Ӧ��ƽ�ⳣ��K1=____���������������䣬�����¶���120�棬�ﵽ��ƽ��ʱ��ƽ�ⳣ����K2����K1_____K2(����>������<������=��)��
��3����Ӧ���е�100sʱ����ֻ��һ�����������仯����仯������������____��
A.�����¶� B.ͨ�뺤�� C.���������г���N2O4 D.���������ݻ�
��4����֪��N2(g)+2O2(g)![]() 2NO2(g) ��H=+67.2kJ��mol-1
2NO2(g) ��H=+67.2kJ��mol-1
N2H4(g)+O2(g)![]() N2(g)+2H2O(g) ��H=-534.7kJ��mol-1
N2(g)+2H2O(g) ��H=-534.7kJ��mol-1
N2O4(g)![]() 2NO2(g) ��H=+57.0kJ��mol-1
2NO2(g) ��H=+57.0kJ��mol-1
��2N2H4(g)+N2O4(g)![]() 3N2(g)+4H2O(g) ��H=____kJ��mol-1��
3N2(g)+4H2O(g) ��H=____kJ��mol-1��
��.���ݻ�Ϊ2 L���ܱ�������ͨ��һ������CO��H2O��������Ӧ��CO(g)+H2O(g)![]() H2(g)+CO2(g)��
H2(g)+CO2(g)��
��5������˵������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬�����ݵ���____(����ĸ���)��
A.������CO��H2O��CO2��H2��Ũ��֮��Ϊ1��1��1��1
B.CO������������H2�������������
C.������ѹǿ���ֲ���
D.���������ܶȱ��ֲ���
��6�����������������䣺
������ƽ����ϵ����ͨ��0.20molH2O(g)��ƽ�⽫___(����������������������������)�ƶ����ﵽ�µ�ƽ��״̬��H2O(g)�����������____(�������������С������������)��
����VL�ܱ�������ͨ��10molCO��10molH2O(g)����������Ӧ����T��ﵽƽ�⣬Ȼ���ٳ�ȥˮ����(��ˮ����ʱ�������ɷֵ����ʵ�������)�����������ȼ�գ���÷ų�������Ϊ2842kJ(��֪CO��ȼ����Ϊ283kJ��mol-1��H2��ȼ����Ϊ286kJ��mol-1)����T��ƽ�ⳣ��K=____������ȷ��С�������λ��
���𰸡�1��10-3 0.36 < A -1079.6 B ���� ��� 0.44
��������
��. ��ͼ��֪����ʼʱc( N2O4)=0.1mol/L��60��ʱ��Ӧ����ƽ��״̬ʱc��( N2O4)=0.04mol/L��c��( NO2)=0.12mol/L��
(1)����![]() ����N2O4��ʾ��ƽ����Ӧ����Ϊ
����N2O4��ʾ��ƽ����Ӧ����Ϊ![]() =1��103mol/(Ls)��
=1��103mol/(Ls)��
�ʴ�ΪΪ��1��103��
(2)����ƽ�ⳣ���Ķ���д����ʽK=![]() =0.36����Ϊ�÷�ӦΪ���ȷ�Ӧ�������¶ȶ�ƽ���ƶ���Ӱ���֪������ƽ�������ȷ�Ӧ�����ƶ��������ƶ�������Kֵ���K1<K2��
=0.36����Ϊ�÷�ӦΪ���ȷ�Ӧ�������¶ȶ�ƽ���ƶ���Ӱ���֪������ƽ�������ȷ�Ӧ�����ƶ��������ƶ�������Kֵ���K1<K2��
�ʴ�Ϊ��0.36��<��
(3)����ͼ���֪��100sʱN2O4Ũ����ԭ���Ļ����ϱ��NO2��Ũ����ԭ���Ļ����ϱ�С��˵��ƽ�����淴Ӧ�����ƶ�����ͨ���¶ȵı仯��Ӱ��ģ����÷�ӦΪ���ȷ�Ӧ�����Ըı������Ϊ���£�
��ѡA��
��4��)��N2(g)+2O2(g)�T2NO2(g) ��H=+67.2kJmol1��
��N2H4(g)+O2(g)�TN2(g)+2H2O(g) ��H=534.7kJmol1��
��N2O4(g)2NO2(g) ��H=+57.0kJmol1��
���ݸ�˹����,�ڡ�2��+�ۿ�д���Ȼ�ѧ����ʽ2N2H4(g)+N2O4(g)�T3N2(g)+4H2O(g)��H=534.7kJmol1��267.2kJmol1+57.0kJmol1=1079.6kJmol1��
�ʴ�Ϊ��1079.6��
��. ��5��A. ��Ӧ��ƽ��״̬ʱ����Ӧ������Ũ�ȱ��ֲ��䣬��һ����Ȼ�ɱ�������A����
B. CO������������H2 ���������ʷֱ��ʾ������������Ӧ��������ʣ�B��ȷ��
C. ���ڷ�Ӧǰ��������������䣬�ҷ�Ӧ��Ͳ���������壬������ѹǿʼ�ձ��ֲ��䣬��C����
D. ���ڷ�Ӧǰ��������������䣬�ҷ�Ӧ��Ͳ���������壬���������ܶ�ʼ�ձ��ֲ��䣬��D����
��ѡB��
��6�������������������䣬��ƽ����ϵ����ͨ��0.20 mol H2O(g)����ԭƽ����ȣ�ƽ�������ƶ���������ͨ����H2O(g)���ʴﵽ�µ�ƽ��״̬��H2O(g)������������
��Ϊ�����ң����
����ﵽƽ��ʱn(H2 )=a mol����n(CO)=(10-a)mol����a286 kJ��mol-1+(10-a)��283 kJ��mol-1=2842 kJ�����a=4��K=![]() =
=![]() ��0.44��
��0.44��
����0.44��

����Ŀ��ijС��̽����ϴ�Թܣ��ڱڸ����������ķ�Ӧԭ������������ʵ�顣
I.����̽��
��1����ϡ������븽���������Թ��У���¼�������£�
ʵ��� | ʵ����� | ʵ������ |
| �����ϳ������ݣ���Һ���·�Ϊ��ɫ���壬���Թܿڸ���......���Թ��ڱ��ϵ������ܽ⡣ |
�ٲ�ȫ��Ӧ�е�ʵ������___��
��ʵ�����������ʧ������Ӧ�Ļ�ѧ����ʽΪ____��
��2��Ϊ����ʵ����е����������Ⱦ����˫��ˮ��Һ���븽���������Թ��С�
ʵ��� | ʵ����� | ʵ������ |
| ���ҷ�Ӧ���д�����ɫ������������������ʹ�����ǵ�ľ����ȼ���Թ��ڱ��ϵ������ܽ⡣ |
���������Ʋ�H2O2��Ag����ΪAg+����ͨ��ʵ���ų������ֿ��ܡ���ʵ�鷽���ǣ��ڷ�Ӧ���Һ���У�����___��
�ڲ������Ϸ��֣���ʵ���������ܽ�����ղ���Ϊ������С��ֱ����1��100nm֮�䣩��Ag�����ɢ��Һ���У�������ʶ�𡣸�ͬѧͨ��ʵ��֤ʵ�����ֿ����ԡ����IJ����������ǣ�___��
��д����ʵ����з�����Ӧ�Ļ�ѧ����ʽ��___��
II.�������ϣ�����̽��
�������ף�Ag2O+4NH3H2O=2[Ag(NH3)2]++2OH-+3H2O
��3��̽��Ag2O��H2O2�ֽⷴӦ�е����ã���������ʵ�顣
ʵ��� | ʵ����� | ʵ������ |
| ���ҷ�Ӧ��������������ɫ���壬ͬʱ���Թܵײ�����������ɫ���� |
����ʵ����������룺Ag2O�ڷ�Ӧ����������������ʵ�飬��ʵ���Ӧ����Թ��м�����������Һx��������ʣ�ࡣ�ɴ���֤�˸ò������ȷ��
����ʵ���м�����������Һx��____��
��ʵ����з�����Ӧ�Ļ�ѧ����ʽΪ___��