题目内容
【题目】某研究团队实现了电化学合成(又称电解合成)H2O2,该方法的原理如图所示,下列有关说法错误的是( )
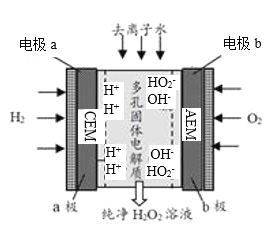
![]()
A.电极a为阳极,CEM为阳离子交换膜
B.该方法是一种制取H2O2的绿色方法
C.电极b上的电极反应式为O2+H+-2e-=HO2-
D.通过调节通入去离子水的量可以控制流出溶液中H2O2的浓度
【答案】C
【解析】
结合图可知,电极a为阳极,H2阳极失电子得H+;电极b为阴极,O2在阴极得电子得HO2-,HO2-和H+分别穿过AEM、CEM在多孔固体电解质内结合生成H2O2,据此解答。
A.HO2-和H+分别穿过AEM、CEM在多孔固体电解质内结合生成H2O2,则CEM为阳离子交换膜,A正确;
B.该方法制取H2O2无污染物产生,为绿色方法,B正确;
C.电极b为阴极,O2在阴极得电子变为HO2-,结合得失电子守恒、电荷守恒、原子守恒可得电极反应式为:O2+2e-+H2O=HO2-+OH-,C错误;
D.未反应的去离子水溶解H2O2后流出,故通过调节通入去离子水的量可以控制流出溶液中H2O2的浓度,D正确。
答案选C。

练习册系列答案
相关题目