题目内容
【题目】金属镓有“电子工业脊梁”的美誉,镓及其化合物应用广泛。
(1)一种镍催化法生产GaN的工艺如图:
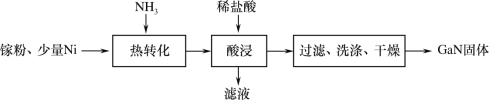
①镓(Ga)的原子结构示意图为![]() ,镓元素在周期表中的位置是___。
,镓元素在周期表中的位置是___。
②“热转化”时Ga转化为GaN的化学方程式是___。
③“酸浸”操作目的是___。
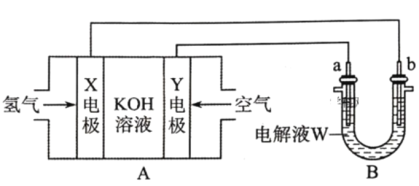
(2)某学校化学兴趣小组在实验室利用如图装置模拟制备氮化镓:
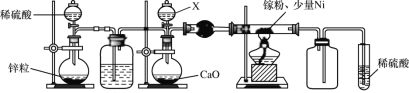
①仪器X中的试剂是__,加热前需先通入一段时间的H2,原因是__。
②取某GaN样品m克溶于足量热NaOH溶液,发生反应GaN+OH﹣+H2O![]() GaO2-+NH3↑,用H3BO3溶液将产生
GaO2-+NH3↑,用H3BO3溶液将产生![]() NH3完全吸收,滴定吸收液时消耗浓度为cmol/L的盐酸VmL,则样品的纯度是___。
NH3完全吸收,滴定吸收液时消耗浓度为cmol/L的盐酸VmL,则样品的纯度是___。
已知:NH3+H3BO3=NH3H3BO3;NH3H3BO3+HCl=NH4Cl+H3BO3
【答案】第四周期ⅢA族 2Ga+2NH3![]() 2GaN+3H2 除去GaN中混有的少量Ni 浓氨水 排除装置中的空气,避免空气与镓反应,使产物不纯,防止氢气与氧气爆炸
2GaN+3H2 除去GaN中混有的少量Ni 浓氨水 排除装置中的空气,避免空气与镓反应,使产物不纯,防止氢气与氧气爆炸 ![]() %
%
【解析】
(1)由流程图可知,在少量Ni做催化剂作用下,Ga粉与氨气高温下反应生成GaN和H2,反应得到混有Ni的GaN混合物,向反应后的固体中加入稀盐酸,Ni溶于稀盐酸生成可溶的氯化镍,GaN不与稀盐酸反应,过滤、洗涤、干燥得到GaN;
(2)由实验装置图可知,实验时,应先制备氢气,利用氢气排除装置中的空气,避免空气与镓反应,防止空气中氧气和反应生成的氢气加热混合发生爆炸,当装置中空气排尽后,再用浓氨水与氧化钙反应制备氨气,在少量Ni做催化剂作用下,Ga粉与氨气加热反应生成GaN和H2,由于氨气与稀硫酸反应,在吸收装置前连接一个空载仪器,起防止倒吸的作用。
(1)镓的原子结构示意图为![]() 可知,镓原子有4个电子层,最外层有3个电子,则镓元素位于周期表第四周期ⅢA族,故答案为:第四周期ⅢA族;
可知,镓原子有4个电子层,最外层有3个电子,则镓元素位于周期表第四周期ⅢA族,故答案为:第四周期ⅢA族;
②由流程图可知,“热转化”的过程为在少量Ni做催化剂作用下,Ga粉与氨气高温下反应生成GaN和H2,反应的化学方程式为2Ga+2NH3![]() 2GaN+3H2,故答案为:2Ga+2NH3
2GaN+3H2,故答案为:2Ga+2NH3![]() 2GaN+3H2;
2GaN+3H2;
③由分析可知反应得到混有Ni的GaN混合物,酸浸的目的是使Ni溶于稀盐酸,除去GaN中混有的少量Ni,故答案为:除去GaN中混有的少量Ni;
(2)①仪器X中的试剂是浓氨水,目的是用浓氨水与氧化钙反应制备氨气;空气中的氧气能与镓反应,且镓与氨气反应生成的氢气能与空气中氧气反应,发生爆炸,所以加热前需先通入一段时间的H2,排除装置中的空气,避免空气与镓反应,使产物不纯,防止氢气与氧气爆炸,故答案为:排除装置中的空气,避免空气与镓反应,使产物不纯,防止氢气与氧气爆炸;
②由题给化学方程式可得如下关系式:GaN—NH3—NH3H3BO3—HCl,由关系式可知n(GaN)=n(HCl)=10-3cVmol,则样品的纯度为![]() ×100%=
×100%=![]() %,故答案为:
%,故答案为:![]() %。
%。

【题目】Ⅰ.已知C、H2、CO的燃烧热的数据如表所示:
物质 | C | H2 | CO |
ΔH/kJ·mol-1 | -393.5 | -285.8 | -283.0 |
(1)写出C完全燃烧的热化学方程式:_____。
(2)能表示H2燃烧热的热化学方程式为____。
(3)现以H2或CO为燃料来提供热能,从热能的角度考虑,你认为最好选择__(填写序号)。
A.H2 B.CO C.均可以
理由是___。
Ⅱ.已知下列热化学方程式:
①H2O(l)=H2(g)+![]() O2(g) ΔH=+285.8 kJ/mol
O2(g) ΔH=+285.8 kJ/mol
②H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8 kJ/mol
O2(g)=H2O(g) ΔH=-241.8 kJ/mol
③NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ/mol
回答下列问题:
(4)上述反应中属于吸热反应的是___(填序号)。
(5)燃烧10gH2生成液态水,放出的热量为___。
【题目】合理利用资源成为当今研究热点。CH3NH2、PbI2及HI常用作合成太阳能电池的敏化剂甲胺铅碘(CH3NH3PbI3)的主要原料。
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键 | C-O | H-O | N-H | C-N |
键能/kJ·mol-1 | E1 | E2 | E3 | E4 |
则上述热化学方程式中ΔH=___kJ·mol-1。
(2)可利用水煤气合成上述反应所需甲醇。反应为CO(g)+2H2(g)![]() CH3OH(g)ΔH<0。在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g)ΔH<0。在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
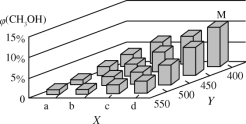
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为___。
②图中Y轴表示温度,其判断的理由是__。
(3)可利用四氧化三铅和氢碘酸反应制备难溶PbI2,若反应中生成amolPbI2,则转移电子的物质的量为___。
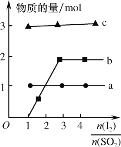
(4)将二氧化硫通入碘水制备HI的反应曲线如图所示,其反应原理为:SO2+I2+2H2O=3H++HSO4-+2I-,I2+I-![]() I3-,图中曲线a、b分别代表的微粒是__和__(填微粒符号);由图知要提高碘的还原率,除控制温度外,还可以采取的措施是___。
I3-,图中曲线a、b分别代表的微粒是__和__(填微粒符号);由图知要提高碘的还原率,除控制温度外,还可以采取的措施是___。