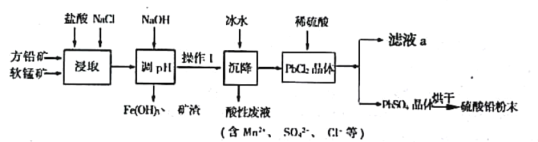
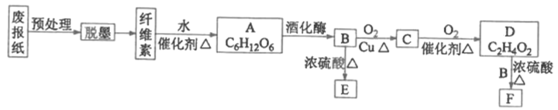
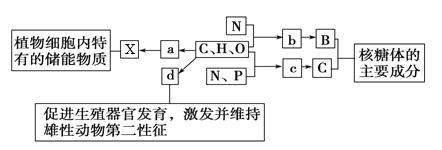
题目内容
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。已知H为固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。
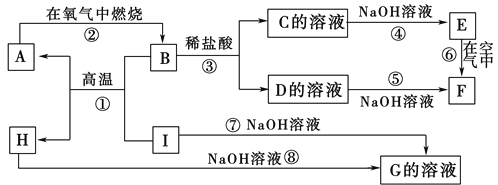
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素的名称是________。
(2)反应①的化学方程式为_____________________________________
反应③的离子方程式为________________________
反应⑧的化学方程式为_____________________________________
(3)反应⑥过程中的现象是______________________________。
(4)1molI发生反应后生成的A高温下与足量的水蒸气反应,生成的气体换算成标准状况下占______L。
【答案】铁元素8Al+3Fe3O4 ![]() 4Al2O3+9FeFe3O4+8H+=2Fe3++Fe2+ +4H2OAl2O3+2NaOH=2NaAlO2+H2O生成的白色沉淀在空气中迅速变成灰绿色,最后变成红褐色33.6
4Al2O3+9FeFe3O4+8H+=2Fe3++Fe2+ +4H2OAl2O3+2NaOH=2NaAlO2+H2O生成的白色沉淀在空气中迅速变成灰绿色,最后变成红褐色33.6
【解析】
试题F是红褐色难溶于水的沉淀,因此F是氢氧化铁,则E是氢氧化亚铁,所以C和D分别是亚铁盐和铁盐。B和盐酸反应生成C和D,所以B是四氧化三铁,C是氯化亚铁,D是氯化铁,A在氧气中燃烧生成B,则A是铁。H和I均能与氢氧化钠溶液反应生成G,则I是铝,和四氧化三铁发生铝热反应生成铁和氧化铝,H是氧化铝,G是偏铝酸钠,据此分析解答。
解析:F是红褐色难溶于水的沉淀,因此F是氢氧化铁,则E是氢氧化亚铁,所以C和D分别是亚铁盐和铁盐。B和盐酸反应生成C和D,所以B是四氧化三铁,C是氯化亚铁,D是氯化铁,A在氧气中燃烧生成B,则A是铁。H和I均能与氢氧化钠溶液反应生成G,则I是铝,和四氧化三铁发生铝热反应生成铁和氧化铝,H是氧化铝,G是偏铝酸钠,则。
(1)根据以上分析可知A、B、C、D、E、F六种物质中所含的同一种元素的名称是铁。
(2)根据以上分析可知反应①的化学方程式为8Al+3Fe3O4 ![]() 4Al2O3+9Fe。反应③的离子方程式为Fe3O4+8H+=2Fe3++Fe2+ +4H2O;反应⑧的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O。
4Al2O3+9Fe。反应③的离子方程式为Fe3O4+8H+=2Fe3++Fe2+ +4H2O;反应⑧的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O。
(3)反应⑥是氢氧化亚铁被空气氧化,过程中的现象是生成的白色沉淀在空气中迅速变成灰绿色,最后变成红褐色。
(4)根据8Al+3Fe3O4 ![]() 4Al2O3+9Fe可知1mol铝发生反应后生成
4Al2O3+9Fe可知1mol铝发生反应后生成![]() 铁,铁在高温下与足量的水蒸气反应的方程式为3Fe+4H2O(g)
铁,铁在高温下与足量的水蒸气反应的方程式为3Fe+4H2O(g)![]() 4H2+Fe3O4,所以生成的气体换算成标准状况下为
4H2+Fe3O4,所以生成的气体换算成标准状况下为![]() 。
。

 名校课堂系列答案
名校课堂系列答案【题目】N2O俗名为“笑气”,也是一种温室气体。结合所学知识,回答下列问题:
(1)锌与极稀硝酸反应可生成N2O,该反应的化学方程式为___________,其中作氧化剂的硝酸与参与反应的硝酸的物质的量之比为___________。
(2)已知几种物质的相对能量如下:
物质 | N2O(g) | CO(g) | N2(g) | CO2(g) |
相对能量/kJmol-1 | 475.5 | 283.0 | 393.5 | 0 |
①N2O(g)和CO(g)反应生成N2(g)和CO2(g)的热化学方程式为____________。
②若其他条件不变,加入高效催化剂,该反应的焓变将_______(填“增大”、“减小”或“不变”)。
(3)碘蒸气能催化N2O的分解,反应历程(步骤)如下:
i.I2(g)2I(g)
ii.I(g)+N2O(g)=N2(g)+IO(g)
iii.2IO(g)+2N2O(g)=2N2(g)+2O2(g)+I2(g)
实验表明,在反应过程c(I)始终大于c(IO),由此推测,反应速率ii_________iii(填“>”、“<”或“=”)。
(4)一定温度下,向恒容密闭容器中充入2 mol N2O(g)和3 mol NO(g),发生反应:N2O(g)+NO(g)N2(g)+NO2(g) △H。测得N2体积分数与温度、时间的关系如图所示。
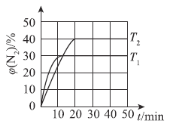
①△H___________0(填“>”、“<”或“=”)。
②下列情况表明该反应达到平衡状态的是___________(填字母)。
A.混合气体的密度不再改变 B.相对分子质量不再改变
C.NO和NO2的消耗速率相等 D.N2O的体积分数不再改变
③T1时,该反应的平衡常数K=___________。