题目内容
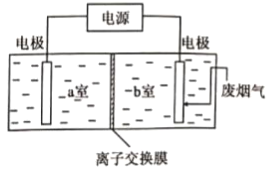
【题目】某水系锂离子电池可实现Li+和Co2+分离回收,其装置如图。25℃时,Co(OH)2的Ksp分别为6.31×10—15,LiOH的溶解度为12.7g.下列说法不正确的是

A.负极材料中发生变价的元素是Ti
B.交换膜a为阳离子交换膜
C.负极液和正极液中的c(Li+)均变大
D.在过滤层可收集到Co(OH)2
【答案】B
【解析】
A、由图可知,通入O2的电极为正极,放电过程中,负极材料Li2Ti2(PO4)2中Ti元素化合价升高,故A不符合题意;
B、正极发生反应:O2+4e-+2H2O=4OH-,为实现Li+和Co2+分离回收,交换膜b应选用阳离子交换膜,由溶液呈电中性可知,交换膜a为阴离子交换膜,故B符合题意;
C、负极材料中Ti元素化合价升高,生成Li+,废液中Li+向正极液中移动,故负极液和正极液中的c(Li+)均变大,故C不符合题意;
D、正极液中生成了OH-,Co2+与OH-会反应生成Co(OH)2,在过滤层中沉积,故D不符合题意;
故答案为B。

练习册系列答案
相关题目