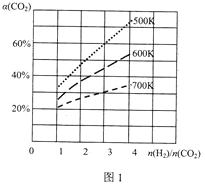
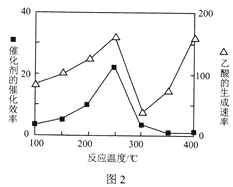
题目内容
【题目】用如图所示装置进行下列实验,其中不合理的是

A.用CCl4萃取碘水中的碘B.用NaOH溶液除去溴苯中的溴
C.用水除去硬脂酸钠中的甘油D.用饱和Na2CO3溶液除去乙酸乙酯中的乙酸
【答案】C
【解析】
由图可知,为萃取、分液装置,可分离溶质在不同溶剂中溶解性差异大的混合物,或分离分层的液体,以此来解答。
A、用CCl4萃取碘水中的碘的实验操作为萃取、分液,可通过该装置完成,故A不符合题意;
B、溴苯在水中溶解度较小,溴在溴苯中溶解度较大,向溴苯与溴的溶液中加入NaOH溶液后,溴与NaOH反应,生成无机盐,无机盐易溶于水,难溶于溴苯,可分层,然后通过分液分离出溴苯,故B不符合题意;
C、硬脂酸钠、甘油均溶于水,不能利用图中装置分离,故C符合题意;
D、乙酸与碳酸钠反应后,与乙酸乙酯分层,可利用图中装置、饱和Na2CO3溶液除去乙酸乙酯中的乙酸,故D不符合题意;
故答案为C。

【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n (H2O)/ mol |
0 | 1.20 | 0.60 |
t1 | 0.20 | |
t2 | 0.80 |
依据题意回答下列问题:
(1)反应在t1min内的平均速率为v(H2)=____________mol·L-1·min-1
(2)保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=____________mol。
(3)温度升至800℃,上述反应平衡常数为0.64,则正反应为__________反应(填“放热”或“吸热”)。
(4)700℃时,向容积2L的密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为1.20mol、2.00mol、1.20mol、1.20mol,则此时该反应v(正)______v(逆)(填“>”、“<”或“=”)。
(5)若该容器体积不变,能判断反应达到平衡的是_______________。
①c(CO)与c(H2)的比值保持不变;②v(CO2)正=v(H2O)逆;③体系的压强不再发生变化;④混合气体的密度不变;⑤体系的温度不再发生变化;⑥气体的平均相对分子质量不变