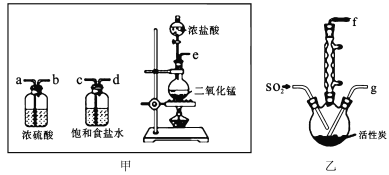
��Ŀ����
����Ŀ����̼���ó�Ϊ����һ���µ��������������̼�IJ���������һ����Ҫ�о����� �ȿɱ��Ϊ�����ֿɼ���̼���ŷš���ҵ�Ͽ���CO2��H2�Ʊ�����Ϊ��21���͵����ȼ����������(CH3OCH3)��
����500��ʱ�����ܱ������н������е�CO2ת��Ϊ�����ѣ�����ط�ӦΪ��
����ӦI��2CO2 (g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ��H1
CH3OCH3(g)+3H2O(g) ��H1
����ӦII��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H2
CH3OH(g)+H2O(g) ��H2
(1)��֪����CO(g)+2H2(g)![]() CH3OH(g) ��H=-90.1kJ/mol
CH3OH(g) ��H=-90.1kJ/mol
��2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ��H=-24.5kJ/mol
CH3OCH3(g)+H2O(g) ��H=-24.5kJ/mol
��CO(g)+H2O(g)![]() CO2(g)+H2(g) ��H= -41.0kJ/mol
CO2(g)+H2(g) ��H= -41.0kJ/mol
������ӦI����H1=______��
(2)��һ���¶���ij�ܱ������а�CO2��H2��Ũ�ȱ�Ϊ1��3Ͷ�Ͻ��з�Ӧ����ò�ͬʱ��β������ʵ�Ũ�����±���

��10-20min �ڣ�CH3OCH3��ƽ����Ӧ����v(CH3OCH3)=_______��
�ڸ����������ݼ�������ӦI��ƽ�ⳣ��K=______(��ʽ���������ݣ���������)��
(3)�����CH3OCH3���ʵĹؼ���������ѡ�ú��ʵĴ�������ԭ����_______��
(4)���ڷ�ӦII���¶ȶ�CO2��ת���ʼ�������Ч��Ӱ����ͼ��ʾ�������й�˵������ȷ����_______��

A.�����������䣬����ʹ�ô�������250��ʱCO2��ƽ��ת���ʿ���λ��Ml
B.�¶ȵ���250��Cʱ�����¶����״��IJ�������
C.M��ʱƽ�ⳣ����N��ʱƽ�ⳣ����
D.ʵ�ʷ�ӦӦ�������ڽϵ͵��¶��½��У������CO2��ת��
(5)����̫���ܵ�ؽ�CO2ת��Ϊ��ϩ����ϩ���л�����ԭ�ϣ��乤��ԭ����ͼ��ʾ����aΪ̫���ܵ�ص�_______����дM�������ɱ�ϩ�ĵ缫��ӦʽΪ_________��

���𰸡�-122.7kJ/mol 0.003mol/(L��min) 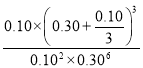 �ʵĴ����ܴ���������Ӧ���ʣ��Ӷ���߶����ѵIJ��� ABD ���� 3CO2+18H++18e-=6H2O+CH3CH=CH2
�ʵĴ����ܴ���������Ӧ���ʣ��Ӷ���߶����ѵIJ��� ABD ���� 3CO2+18H++18e-=6H2O+CH3CH=CH2
��������
(1)���ݸ�˹���ɣ�����֪�������Ȼ�ѧ����ʽ���ӣ��ɵ�����ӦI���Ȼ�ѧ����ʽ��
(2)�ٸ���v=![]() ���㷴Ӧ���ʣ�
���㷴Ӧ���ʣ�
�ڸ���ƽ�ⳣ���ĺ������÷�Ӧ�ﵽƽ��ʱ�Ļ�ѧƽ�ⳣ����
(3)���ݴ��������÷����жϣ�
(4)�����¶ȡ������Ի�ѧ��Ӧ���ʡ���ѧƽ���ƶ���Ӱ��������жϣ�
(5)���ݵ���ԭ�������жϣ���д�缫��Ӧʽ��
(1)��CO(g)+2H2(g)![]() CH3OH(g) ��H=-90.1 kJ/mol
CH3OH(g) ��H=-90.1 kJ/mol
��2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ��H=-24.5 kJ/mol
CH3OCH3(g)+H2O(g) ��H=-24.5 kJ/mol
��CO(g)+H2O(g)![]() CO2(g)+H2(g) ��H= -41.0 kJ/mol
CO2(g)+H2(g) ��H= -41.0 kJ/mol
����2+��-����2�������ɵ�2CO2 (g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ��H1=-122.7 kJ/mol��
CH3OCH3(g)+3H2O(g) ��H1=-122.7 kJ/mol��
(2)��ϱ������ݣ�����v=![]() ��֪��10��20min �ڣ�CH3OCH3��ƽ����Ӧ����v(CH3OCH3)=
��֪��10��20min �ڣ�CH3OCH3��ƽ����Ӧ����v(CH3OCH3)=![]() =0.003 mol/(L��min)��
=0.003 mol/(L��min)��
�ڷ�Ӧ��ʼ��c(H2)=1.00 mol��ƽ��ʱc(H2)=0.30 mol����Ӧ��Ӧ����H2Ũ��Ϊ��c(H2)=(1.00-0.30) mol/L=0.70 mol/L�����з�����Ӧ��2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)��c(CH3OCH3)=0.10 mol/L����c(H2O)=0.30 mol/L����Ӧ����H2Ũ��Ϊ0.60mol/L����������ӦCO2(g)+3H2(g)
CH3OCH3(g)+3H2O(g)��c(CH3OCH3)=0.10 mol/L����c(H2O)=0.30 mol/L����Ӧ����H2Ũ��Ϊ0.60mol/L����������ӦCO2(g)+3H2(g)![]() CH3OH(g)+2H2O(g)����H2�ķ�Ũ����0.10mol/L���������H2O��Ũ����
CH3OH(g)+2H2O(g)����H2�ķ�Ũ����0.10mol/L���������H2O��Ũ����![]() mol/L������ƽ��ʱˮ��Ũ����c(H2O)=(0.30+
mol/L������ƽ��ʱˮ��Ũ����c(H2O)=(0.30+![]() )mol/L����CO2��H2��Ũ�ȱ�Ϊ1��3Ͷ�ϣ�����������ӦʱCO2��H2�ǰ�1��3��ϵ��Ӧ���ﵽƽ��ʱ���ߵ����ʵ���Ũ�ȱ�Ҳ��1��3����Ӧ�ﵽƽ��ʱc(CO2)=��
)mol/L����CO2��H2��Ũ�ȱ�Ϊ1��3Ͷ�ϣ�����������ӦʱCO2��H2�ǰ�1��3��ϵ��Ӧ���ﵽƽ��ʱ���ߵ����ʵ���Ũ�ȱ�Ҳ��1��3����Ӧ�ﵽƽ��ʱc(CO2)=��![]() -0.2+
-0.2+![]() ��=0.10 mol/L��������ӦI�ﵽƽ��ʱ�Ļ�ѧƽ�ⳣ��K=
��=0.10 mol/L��������ӦI�ﵽƽ��ʱ�Ļ�ѧƽ�ⳣ��K=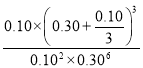 ��
��
(3)��Щ���ʶ�ijһ��Ӧ�д����ã���������Ӧ���������û��Ч�ʺܵͣ������ʵ��Ĵ����ܴ���������Ӧ���ʣ����ٸ���Ӧ�ķ������Ӷ���߶����ѵIJ��ʣ�
(4)A.��������Ӱ��ƽ���ƶ���ֻ�ܸı䷴Ӧ���ʣ�A����
B.�¶ȵ���250��ʱ�����¶����ߣ�ƽ�������ƶ����״��IJ��ʼ�С��B����
C.�����¶ȶ�����̼��ƽ��ת���ʽ��ͣ�������ƽ�������ƶ�������M��ʱ��ѧƽ�ⳣ������N�㣬C��ȷ��
D.�ϵ͵��¶��½��з�Ӧ��ƽ��������У�CO2��ת���ʽϸߣ��������Ļ��ԡ���Ӧ���ʼ�С�������ڷ�Ӧ���У�D����
�ʺ���ѡ����ABD��
(5)CO2��M�缫�õ����ӣ�����ԭ������ϩ����M�缫Ϊ���������Դ�������ӵĵ缫Ϊ����������a�缫Ϊ������M�缫�ĵ缫��ӦʽΪ��3CO2+18H++18e-=6H2O+CH3CH=CH2��

����Ŀ��NO��NO2������β������Ҫ�ĺ���������ش��������⣺
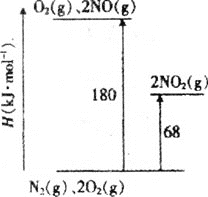
��1����֪��������ת�������е������仯��ͼ(ͼ�б�ʾ����2molNO2�������仯)��1molNO����ΪNO2���ʱ���H=___��
��2��ij�¶��£���Ӧ��ƽ�ⳣ�����£�
a.2NO2(g)N2(g)+2O2(g) K=6.7��1016
b.2NO(g)N2(g)+O2(g) K=2.2��1030
�ֽⷴӦ���ƽϴ�ķ�Ӧ��___(����a������b��)����Ӧ2NO(g)+O2(g)2NO2(g)��K=___(������λ��Ч����)��
��3����֪��Ӧ2NO(g)+O2(g)2NO2������Ӧ����v��=k1cm(NO)cn(O2)������kΪ���ʳ�������ͨ������ʵ�����ݼ���k��m��n��
��ʼŨ��/molL-1 | |||
��� | NO | O2 | ��ʼ���� /molL-1s-1 |
1 | 0.02 | 0.0125 | 7.98��10-3 |
2 | 0.02 | 0.0250 | 15.96��10-3 |
3 | 0.04 | 0 0125 | 31.92��10-3 |
��k1=___��m=___��n=___��
��4����֪�÷�Ӧ������Ϊ��
��һ����NO+NO![]() N2O2 ����ƽ��
N2O2 ����ƽ��
�ڶ�����N2O2+O2![]() 2NO2 ����Ӧ
2NO2 ����Ӧ
���пɽ�����Ϊ�ڶ�����Ӧ��Ӱ���һ����ƽ�⣬��һ����Ӧ�У�v(��)=k1c2(NO)��v(��)=k-1c(N2O2)������������ȷ����___(����ĸ)��
A.��һ����Ӧ��ƽ�ⳣ��K=![]()
B.v(��һ��������Ӧ)<v(��һ���ķ�Ӧ)
C.�ڶ����Ļ�ܱȵ�һ���Ļ�ܸ�
D.�ڶ�����N2O2��O2����ײ100����Ч
��5��һ�������²��������NO��O2��NO2Ũ�ȷ�����ͼ�仯��
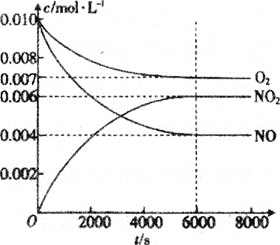
��NO��ƽ��ת����Ϊ___��
�ڸ��¶��·�Ӧ2NO(g)+O2(g)2NO2(g)��ƽ�ⳣ��Ϊ___(��������)��