题目内容
【题目】室温下向10mL0.1mol/LNaOH溶液中加入0.1mol/L的一元酸HA溶液,溶液pH的变化曲线如图所下列说法不正确的是
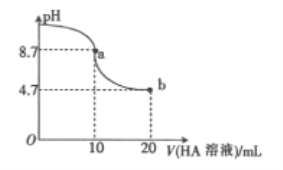
A. a点所示溶液中:c(A-)>c(Na+)>c(OH-)>c(H+)
B. a点所示溶液中:c(Na+)=0.05mol/L
C. pH=7时,c(Na+)=c(A-)
D. b点所示溶液中:c(Na+)<c(A-)
【答案】A
【解析】A.a点时酸碱恰好中和,溶液pH=8.7,NaA溶液水解呈碱性,说明HA为弱酸,因此c(Na+)>c(A-)> c(OH-)>c(H+),故A错误;B.a点时酸碱恰好中和,为NaA溶液,c(Na+)= ![]() =0.05mol/L,故B正确;C.pH=7时,c(H+)=c(OH-),由电荷守恒可知c(Na+)+c(H+)=c(A-)+c(OH-),则c(Na+)=c(A-),故C正确; D.b点HA过量一倍,溶液存在NaA和HA,溶液呈酸性,说明HA电离程度大于A-水解程度,则存在c(A-)>c(Na+),故D正确;故选A。
=0.05mol/L,故B正确;C.pH=7时,c(H+)=c(OH-),由电荷守恒可知c(Na+)+c(H+)=c(A-)+c(OH-),则c(Na+)=c(A-),故C正确; D.b点HA过量一倍,溶液存在NaA和HA,溶液呈酸性,说明HA电离程度大于A-水解程度,则存在c(A-)>c(Na+),故D正确;故选A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】25℃时,几种弱酸的电离平衡常数如下表所示,下列说法正确的是
化学式 | HCOOH | H2CO3 | HCN |
电离平衡常数 | K=1.8×10-4 | K1=4.3×10-7 K2=5.6×10-11 | K=4.9×10-10 |
A. H2CO3溶液和NaCN溶液反应的离子方程式为H2CO3+CN-==HCO3-+HCN
B. HCOOH的电离平衡常数表达式为K= c(HCOOH)/[c(HCOO-)·c(H+)]
C. Na2CO3溶液显碱性,NaHCO3溶液显酸性
D. 酸性强弱顺序是HCOOH>HCN>H2CO3