题目内容
红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中做辅助剂,在化学工业和制药工业中也可做氧化剂,应用领域十分广泛。实验室中红矾钠可用一种铬铁矿(主要成分:FeO·Cr2O3,还含有少量的Al2O3)通过以下过程来制取。
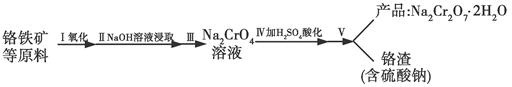
回答下列问题:
(1)步骤Ⅰ中反应化学方程式为4FeO2·Cr2O3(s)+8Na2CO3(s)+7O2(g)=8Na2CrO4(s)+2Fe2O3(s)+8CO2(g)。
①在实验室,步骤Ⅰ应在________(填“陶瓷”或“铁”)坩埚中完成。
②在常温下该反应速率极慢,下列措施中能使反应速率增大的是________(填字母)。
A.将原料粉碎 B.增加纯碱的用量 C.升高温度
(2)步骤Ⅱ中NaOH的作用是________________________(用化学反应方程式表示)。
(3)步骤Ⅳ中发生反应的离子方程式为________;反应完成的标志是________。
(4)利用下面的复分解反应,将红矾钠与KCl固体按1?2物质的量之比混合溶于水后经适当操作可得到K2Cr2O7晶体:Na2Cr2O7+2KCl=K2Cr2O7+2NaCl(已知:温度对氯化钠的溶解度影响很小,对重铬酸钾的溶解度影响较大)
基本实验步骤为①溶解;②________;③________;④冷却,结晶,再过滤得K2Cr2O7晶体。其中③应在________(填“高温”或“低温”)条件下进行。

回答下列问题:
(1)步骤Ⅰ中反应化学方程式为4FeO2·Cr2O3(s)+8Na2CO3(s)+7O2(g)=8Na2CrO4(s)+2Fe2O3(s)+8CO2(g)。
①在实验室,步骤Ⅰ应在________(填“陶瓷”或“铁”)坩埚中完成。
②在常温下该反应速率极慢,下列措施中能使反应速率增大的是________(填字母)。
A.将原料粉碎 B.增加纯碱的用量 C.升高温度
(2)步骤Ⅱ中NaOH的作用是________________________(用化学反应方程式表示)。
(3)步骤Ⅳ中发生反应的离子方程式为________;反应完成的标志是________。
(4)利用下面的复分解反应,将红矾钠与KCl固体按1?2物质的量之比混合溶于水后经适当操作可得到K2Cr2O7晶体:Na2Cr2O7+2KCl=K2Cr2O7+2NaCl(已知:温度对氯化钠的溶解度影响很小,对重铬酸钾的溶解度影响较大)
基本实验步骤为①溶解;②________;③________;④冷却,结晶,再过滤得K2Cr2O7晶体。其中③应在________(填“高温”或“低温”)条件下进行。
(1)①铁 ②AC
(2)Al2O3+2NaOH=2NaAlO2+H2O
(3)2CrO42—+2H+=Cr2O72—+H2O 溶液由黄色变成橙色
(4)②蒸发 ③过滤 高温
(2)Al2O3+2NaOH=2NaAlO2+H2O
(3)2CrO42—+2H+=Cr2O72—+H2O 溶液由黄色变成橙色
(4)②蒸发 ③过滤 高温
(1)①铬铁矿中含有Al2O3,能与陶瓷中的SiO2反应。②A项,将原料粉碎,增大固体接触面积可以加快反应速率;B项,Na2CO3是固体,增加固体的量,对反应速率没有影响;C项,升高温度可以加快反应速率。(2)Al2O3是两性氧化物,可与NaOH溶液反应,将其除去。(3)在酸性条件下Na2CrO4转化为Na2Cr2O7;CrO42—溶液呈黄色,Cr2O72—溶液呈橙色。(4)由信息知,NaCl在水中的溶解度随温度变化不大,而重铬酸钾溶液的溶解性受温度变化影响较大,要分离两溶质可使用降温结晶法。
点拨:本题考查化学与技术,考查考生应用知识解决问题的能力。难度较小。
点拨:本题考查化学与技术,考查考生应用知识解决问题的能力。难度较小。

练习册系列答案
相关题目
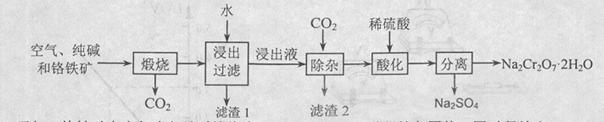
 2NaAlO2+CO2↑。请回答:
2NaAlO2+CO2↑。请回答: ,再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于 mol/L,后续废水处理方能达到国家排放标准。
,再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于 mol/L,后续废水处理方能达到国家排放标准。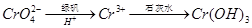 。写出酸性条件下 CrO42-与绿矾在溶液中反应的离子方程式 。
。写出酸性条件下 CrO42-与绿矾在溶液中反应的离子方程式 。


