题目内容
某胃药的主要成分是双羟基铝碳酸钠[NaAl(OH)2CO3],用于抑制胃酸过多。
①如何确认该药物中含有Na元素?
_________________________________________________________________;
②如何确认该药物中含有Al元素和CO32-?
_________________________________________________________________。
①如何确认该药物中含有Na元素?
_________________________________________________________________;
②如何确认该药物中含有Al元素和CO32-?
_________________________________________________________________。
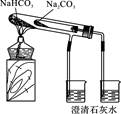
①将药去皮、研碎。用热铂丝蘸粉末在酒精灯火焰上灼烧,火焰呈黄色,证明含有钠元素
②将药去皮、研碎。取粉末放入试管中,加入少量盐酸,有气泡出现证明药中含CO32-。向上层清液中滴加NaOH溶液,有白色沉淀生成,后来沉淀溶解,证明药中含Al元素
②将药去皮、研碎。取粉末放入试管中,加入少量盐酸,有气泡出现证明药中含CO32-。向上层清液中滴加NaOH溶液,有白色沉淀生成,后来沉淀溶解,证明药中含Al元素
①确认是否会含有Na元素,可进行焰色反应。②确认是否含有 CO32-,可用盐酸检验是否有CO2气体放出:NaAl(OH)2CO3+4HCl=NaCl+AlCl3+3H2O+CO2↑确认是否含有 Al元素,可向加盐酸后的溶液中逐滴滴加NaOH溶液,观察发生的现象:
AlCl3+3NaOH=Al(OH)3↓+3NaCl
Al(OH)3+NaOH=Na[Al(OH)4](或NaAlO2+2H2O)
AlCl3+3NaOH=Al(OH)3↓+3NaCl
Al(OH)3+NaOH=Na[Al(OH)4](或NaAlO2+2H2O)

练习册系列答案
相关题目