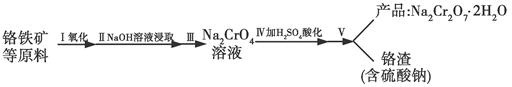
��Ŀ����
����ͪ��һ����Ҫ���л�����ԭ�ϡ�ʵ���Һϳɻ���ͪ�ķ�Ӧ���£�

�������ͻ���ͪ�IJ����������ʼ��±���
����20mL������������Na2Cr2O7������Ļ��Һ��ַ�Ӧ���Ƶ���Ҫ������ͪ��ˮ�Ĵֲ�Ʒ��Ȼ����з����ᴿ������Ҫ������(δ����)��
A������ȥ���Ѻ��ռ�151��~156�����
B��ˮ��������(���ѷе�34.6�棬��ȼ��)��ȡ����ȡҺ�����л���
C������
D����Һ���м���NaCl���������ͣ����ã���Һ
E��������ˮMgSO4���壬��ȥ�л���������ˮ
�ش��������⣺
��1���������ᴿ�������ȷ˳���� ��
��2��b��ˮ����������ȡ��Ŀ���� ��
��3�����¹�����ȡ��Һ�����������У�����ȷ���� ��
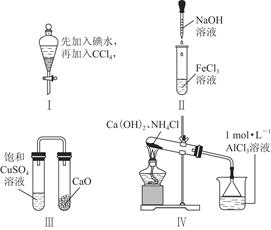
A��ˮ��Һ�м������ѣ�ת������Һ©�������ϲ���������ͼ������

B�����κ����Һ©���ϿڵIJ���������
C�����������������ֳַ�©������Һ��ֲ�
D����Һʱ�����Ƚ��Ͽڲ������������ϵİ��۶�©���ϵ�С�ף��ٴ��������²�Һ��ȫ������ʱ���ٴ��Ͽڵ����ϲ�Һ��
��4������������D�У�����NaCl����������� ����������ѵIJ����в��õļ��ȷ�ʽΪ ��
��5���������ʱ��һ��ʱ�����δͨ����ˮ��Ӧ��ȡ����ȷ������ ��
��6���ָ�������ʱ������õ�����Ʒ���Ϊ12mL����ͪ�IJ���Լ�� ��

�������ͻ���ͪ�IJ����������ʼ��±���
| ���� | ��Է������� | �е�(��) | �ܶ�(g��cm��3��20 ��) | �ܽ��� | |
| ������ | 100 | 161.1 | 0.9624 | ������ˮ���� | |
| ����ͪ | 98 | 155.6 | 0.9478 | ����ˮ���������� | |
����20mL������������Na2Cr2O7������Ļ��Һ��ַ�Ӧ���Ƶ���Ҫ������ͪ��ˮ�Ĵֲ�Ʒ��Ȼ����з����ᴿ������Ҫ������(δ����)��
A������ȥ���Ѻ��ռ�151��~156�����
B��ˮ��������(���ѷе�34.6�棬��ȼ��)��ȡ����ȡҺ�����л���
C������
D����Һ���м���NaCl���������ͣ����ã���Һ
E��������ˮMgSO4���壬��ȥ�л���������ˮ
�ش��������⣺
��1���������ᴿ�������ȷ˳���� ��
��2��b��ˮ����������ȡ��Ŀ���� ��
��3�����¹�����ȡ��Һ�����������У�����ȷ���� ��
A��ˮ��Һ�м������ѣ�ת������Һ©�������ϲ���������ͼ������

B�����κ����Һ©���ϿڵIJ���������
C�����������������ֳַ�©������Һ��ֲ�
D����Һʱ�����Ƚ��Ͽڲ������������ϵİ��۶�©���ϵ�С�ף��ٴ��������²�Һ��ȫ������ʱ���ٴ��Ͽڵ����ϲ�Һ��
��4������������D�У�����NaCl����������� ����������ѵIJ����в��õļ��ȷ�ʽΪ ��
��5���������ʱ��һ��ʱ�����δͨ����ˮ��Ӧ��ȡ����ȷ������ ��
��6���ָ�������ʱ������õ�����Ʒ���Ϊ12mL����ͪ�IJ���Լ�� ��
��1��D B E C A
��2��ʹˮ�����������л����һ������ȡ����߲�Ʒ�IJ���
��3��A B C
��4�����ͻ���ͪ���ܽ�ȣ�����ˮ����ܶȣ������ڷֲ� ˮԡ����
��5��ֹͣ���ȣ���ȴ��ͨ����ˮ
��6��60%(60.3%)
��2��ʹˮ�����������л����һ������ȡ����߲�Ʒ�IJ���
��3��A B C
��4�����ͻ���ͪ���ܽ�ȣ�����ˮ����ܶȣ������ڷֲ� ˮԡ����
��5��ֹͣ���ȣ���ȴ��ͨ����ˮ
��6��60%(60.3%)
�����������1����������������ȡ�����ʻ���ͪ�к���δ��Ӧ�Ļ����������ڻ�����������ˮ���ѣ�������ͪ����ˮ���������ѣ������ᴿ�������ȷ������������Һ���м���NaCl���������ͣ����ã���Һ��Ȼ��ˮ��������(���ѷе�34.6�棬��ȼ��)��ȡ����ȡҺ�����л��㣻�ټ�����ˮMgSO4���壬��ȥ�л���������ˮ�����Ž��й��ˣ���ȥMgSO4���塣�������ȥ���Ѻ��ռ�151��~156����ּ��õ������Ļ���ͪ����2����B��ˮ����������ȡ��Ŀ����ʹˮ�����������л����һ������ȡ����߲�Ʒ�IJ�������3���������������ס��Һ©������������ѹס��Һ©���ڲ����ѷ�Һ©����ת������ʹ����Һ���ֽӴ������������©��������ų�. ��Һʱ��Ϊ��ʹҺ���ܹ�˳�����������Ƚ��Ͽڲ������������ϵİ��۶�©���ϵ�С�ף��²�Һ����¿��������ϲ��Һ����Ͽڵ�������ˣ�����IJ���ΪA B C ����4������������D�У�����NaCl����������ǽ��ͻ���ͪ���ܽ�ȣ�����ˮ����ܶȣ������ڷֲ㡣����������ѵIJ�����Ϊ�˼��ٻ���ͪ�Ļӷ���ɵ����ġ�ͨ�����õļ��ȷ�ʽΪˮԡ���ȡ���5���������ʱ��һ��ʱ���������δͨ����ˮ��Ӧ��ȡ����ȷ������ֹͣ���ȣ���ȴ��ͨ����ˮ������ᵼ��������ը�ѡ���6��ʵ�ʲ�����m(����ͪ)=" 0.9478g/ml��12mL=" 11.3736g.n(����ͪ)=m��M=11.3736g��98g/mol="0.116mol." m(������)= 0.9624g/ml��20ml=19.248g.n(��������=19.248g ��100g/mol="0.19248mol" .���Ի���ͪ�IJ���Ϊ��(0.116mol��0.19248mol����100% ="60%" ��

��ϰ��ϵ�д�
�����Ŀ
 N2O4��g�� ��H<0
N2O4��g�� ��H<0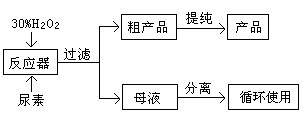


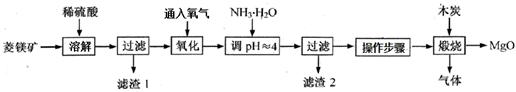
 2MgO+2SO2��+CO2���� MgSO4+C
2MgO+2SO2��+CO2���� MgSO4+C MgO+S��+3CO����
MgO+S��+3CO����