题目内容
19.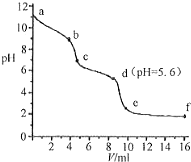 常温下,将已知浓度的盐酸滴定到未知浓度的Na2CO3溶液,用pH传感器测得混合溶液的pH变化曲线,如图所示:(已知饱和CO2溶液的pH为5.6)下列说法正确的是( )
常温下,将已知浓度的盐酸滴定到未知浓度的Na2CO3溶液,用pH传感器测得混合溶液的pH变化曲线,如图所示:(已知饱和CO2溶液的pH为5.6)下列说法正确的是( )| A. | a点时,溶液呈碱性的原因是CO32-发生水解反应,其离子方程式为:CO32-+2H2O=H2CO3+2OH- | |
| B. | a→b段,溶液有气体放出 | |
| C. | c点以后,盐酸过量 | |
| D. | d点溶液中c(Na+)=c(Cl-) |
分析 A、碳酸根为弱酸根,水解分为两步进行,且需要可逆号;
B、a→b段,碳酸钠与盐酸反应生成碳酸氢钠,无二氧化碳气体放出;
C、c点溶液的pH=7,此时溶液呈中性,据此解答即可;
D、d点为二氧化碳的饱和溶液,此时溶液中的溶质为NaCl,据此解答即可.
解答 解:A、碳酸根水解生成碳酸氢根,水解方程式为:CO32-+H2O?HCO3-+OH-,故A错误;
B、a→b段,碳酸钠与盐酸反应生成碳酸氢钠,离子方程式为:CO32-+H+?HCO3-,无气体放出,故B错误;
C、c点溶液的pH=7,此时溶液呈中性,盐酸不过量,若盐酸过量,溶液应呈酸性,故C错误;
D、d点为二氧化碳的饱和溶液,此时c(Na+)=c(Cl-),故D正确,故选D.
点评 本题主要考查的是酸与盐的反应原理,涉及盐类的水解、多元弱酸根与氢离子结合的原理、pH值的应用等,综合性较强,有一定的难度.

练习册系列答案
相关题目
7.将一定量铁粉和铜粉的混合物加入由稀硫酸和稀硝酸组成的混合溶液中,充分反应后金属粉末有剩余,下列有关推断正确的是( )
| A. | 反应过程中不可能产生H2 | |
| B. | 剩余的金属粉末中一定有铜 | |
| C. | 往反应后的溶液中加入KSCN 溶液会变血红色 | |
| D. | 往反应后的溶液中加入足量的稀H2SO4,则金属粉末的质量一定会减少 |
14.CO2溶于水生成碳酸.已知下列数据:
现有常温下1mol•L-1的(NH4)2CO3溶液,已知NH4+的水解平衡常数Kh=$\frac{{K}_{w}}{{K}_{b}}$,CO32-第一步水解的平衡
常数Kh=$\frac{{K}_{w}}{{K}_{{a}_{2}}}$.下列说法正确的是.
| 若电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数(25℃) | ${K}_{{a}_{1}}$=4.30×107 ${K}_{{a}_{2}}$=5.61×10-11 | Kh=1.77×10-5 |
常数Kh=$\frac{{K}_{w}}{{K}_{{a}_{2}}}$.下列说法正确的是.
| A. | 由数据可判断该溶液呈酸性 | |
| B. | c(NH4+)>c(HCO32-)>c(CO32-)>c(NH3•H2O) | |
| C. | c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| D. | c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
4.下列反应的离子方程式正确的是( )
| A. | 碳酸钠的水解反应 CO32-+H2O→HCO3-+OH - | |
| B. | 碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3-+2OH-→CaCO3↓+2H2O+CO32- | |
| C. | 苯酚钠溶液与二氧化碳反应 C6H5O-+CO2+H2O→C6H5OH+CO32- | |
| D. | 稀硝酸与过量的铁屑反应 3Fe+8H++2NO3-→3Fe3++2NO↑+4 H2O |
11.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 0.2molAl与足量NaOH溶液反应,生成的H2分子数为0.3NA | |
| B. | 常温下,1LpH=1的盐酸溶液,由水电离的H+离子数目为0.1NA | |
| C. | 铅蓄电池中,当正极增加9.6g时,电路中通过的电子数目为0.2NA | |
| D. | 11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4 反应中,6 mol CuSO4能氧化白磷的分子数为1.1NA |
6.迷迭香酸具有抗氧化、延缓衰老、减肥降脂等功效,它的结构简式为
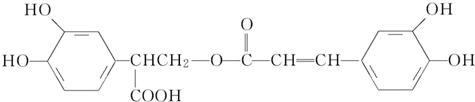 ,
,
以邻苯二酚为原料合成迷迭香酸的路线为
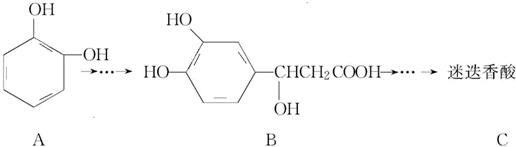
下列说法正确的是( )
 ,
,以邻苯二酚为原料合成迷迭香酸的路线为

下列说法正确的是( )
| A. | 有机物B可以发生取代、加成、消去、氧化反应 | |
| B. | 有机物A分子中所有原子一定在同一平面上 | |
| C. | 有机物C在浓硫酸催化下水解的一种产物是B | |
| D. | 1 mol B与足量的NaOH溶液反应,最多可消耗4 mol NaOH |
6.Mg,Mg2+两种粒子中不相同的是( )
①核内质子数
②核外电子数
③最外层电子数
④核外电子层数.
①核内质子数
②核外电子数
③最外层电子数
④核外电子层数.
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
