题目内容
11.设NA为阿伏伽德罗常数的值.下列说法正确的是( )| A. | 0.2molAl与足量NaOH溶液反应,生成的H2分子数为0.3NA | |
| B. | 常温下,1LpH=1的盐酸溶液,由水电离的H+离子数目为0.1NA | |
| C. | 铅蓄电池中,当正极增加9.6g时,电路中通过的电子数目为0.2NA | |
| D. | 11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4 反应中,6 mol CuSO4能氧化白磷的分子数为1.1NA |
分析 A.铝为3价金属,0.2mol铝与氢氧化钠溶液完全反应失去0.6mol电子,根据电子守恒计算出生成氢气的物质的量;
B.盐酸抑制了水的电离,溶液中中的氢氧根离子是水电离的;
C.正极由PbO2→PbSO4,每增重64g转移2mol电子;
D.Cu3P中Cu显+1价,60mol CuSO4参加反应得到60mol电子,P4被氧化到H3PO4,每有1molP4被氧化失去电子20mol,故6 mol CuSO4能氧化0.3 mol 白磷.
解答 解:A.0.2mol铝完全反应失去0.6mol电子,会生成$\frac{0.6mol}{2}$=0.3mol氢气,则生成的H2分子数为0.3NA,故A正确;
B.常温下,1LpH=1的盐酸溶液中含有氢离子的物质的量浓度为:0.1mol/L,盐酸抑制了水的电离,则溶液中的氢氧根离子是水电离的,水电离的氢离子浓度为:1×10-13mol/L,1L该溶液中由水电离的氢离子的物质的量为:1×10-13mol,故B错误;
C.铅蓄电池中,正极:PbO2→PbSO4,每增重64g时转移2mol电子,所以正极增重9.6g转移电子数为0.3NA,故C错误;
D.Cu3P中Cu显+1价,所以60 mol CuSO4参加反应得到60 mol 电子,P4被氧化到H3PO4,每有1 mol P4被氧化失去电子20 mol,所以6 mol CuSO4能氧化0.3 mol 白磷,能氧化白磷的分子数为0.3NA,故D错误;
故选A.
点评 本题考查阿伏伽德罗常数的计算与判断,题目难度中等,涉及知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用基础知识的能力,注意熟练掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的关系.

练习册系列答案
相关题目
2.有机物经核磁共振检测,给出3种信号的有( )
| A. | CH3OH | B. | CH3CH2CH3 | ||
| C. | 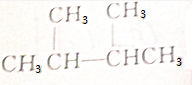 | D. | CH3COOCH2CH3 |
2.下列关于催化剂的说法错误的是( )
| A. | 温度越高,催化剂的催化效果越好 | |
| B. | 汽车排气管上的“催化转化器”能减少有害气体排放 | |
| C. | 催化剂可以改变化学反应速率,但不能破坏化学平衡 | |
| D. | 催化剂可以改变化学反应路径,且反应前后其质量和化学性质都不发生变化 |
19.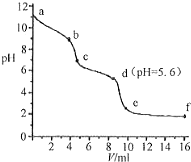 常温下,将已知浓度的盐酸滴定到未知浓度的Na2CO3溶液,用pH传感器测得混合溶液的pH变化曲线,如图所示:(已知饱和CO2溶液的pH为5.6)下列说法正确的是( )
常温下,将已知浓度的盐酸滴定到未知浓度的Na2CO3溶液,用pH传感器测得混合溶液的pH变化曲线,如图所示:(已知饱和CO2溶液的pH为5.6)下列说法正确的是( )
 常温下,将已知浓度的盐酸滴定到未知浓度的Na2CO3溶液,用pH传感器测得混合溶液的pH变化曲线,如图所示:(已知饱和CO2溶液的pH为5.6)下列说法正确的是( )
常温下,将已知浓度的盐酸滴定到未知浓度的Na2CO3溶液,用pH传感器测得混合溶液的pH变化曲线,如图所示:(已知饱和CO2溶液的pH为5.6)下列说法正确的是( )| A. | a点时,溶液呈碱性的原因是CO32-发生水解反应,其离子方程式为:CO32-+2H2O=H2CO3+2OH- | |
| B. | a→b段,溶液有气体放出 | |
| C. | c点以后,盐酸过量 | |
| D. | d点溶液中c(Na+)=c(Cl-) |
16. 已知电解熔融氧化钙可以得到金属钙和氯气,钙在氯气中燃烧又能生成氯化钙.请你根据已学知识,按图中箭头所表示的物质间可能发生的转化,分析下列说法正确的是( )
已知电解熔融氧化钙可以得到金属钙和氯气,钙在氯气中燃烧又能生成氯化钙.请你根据已学知识,按图中箭头所表示的物质间可能发生的转化,分析下列说法正确的是( )
 已知电解熔融氧化钙可以得到金属钙和氯气,钙在氯气中燃烧又能生成氯化钙.请你根据已学知识,按图中箭头所表示的物质间可能发生的转化,分析下列说法正确的是( )
已知电解熔融氧化钙可以得到金属钙和氯气,钙在氯气中燃烧又能生成氯化钙.请你根据已学知识,按图中箭头所表示的物质间可能发生的转化,分析下列说法正确的是( )| A. | CaO、Ca(OH)2、CaCO3三者都是离子化合物,在固态时可以导电 | |
| B. | 工业上也可用电解熔融氧化钙的方法制备金属钙 | |
| C. | 往Ca(OH)2溶液中滴加Na2CO3溶液或NaHCO3溶液,都能实现⑥的转化 | |
| D. | 工业上以氯气和石灰乳为原料通过反应制造主要成分为CaCl2的漂白粉 |
1.除杂和配制试剂是中学化学中常见的实验.对实验方法描述正确的是( )
| A. | 可以通过过滤的方法将淀粉胶体中混有的氯化钠溶液除去 | |
| B. | 在2mL10%的CuSO4(aq)中滴入3滴 2%的NaOH(aq),配制检验醛基的试剂 | |
| C. | 用托盘天平准确称取14.80g Ca(OH)2,配制100mL 2.0 mol/L的Ca(OH)2溶液 | |
| D. | 乙酸乙酯中少量乙醇杂质可加水除去,其原理与溴水中加四氯化碳萃取溴类似 |
18.除去试管中银镜的实验方案如下表所列,实验操作中均经振荡、充分反应:
下列分析结论正确的是( )
| 方案 | 实验操作 | 现象 |
| Ⅰ | 将2mL 2mol/L Fe(NO3)3溶液加入有银镜的试管中 | 银镜较迅速消失 试管口产生红棕色气体 |
| Ⅱ | 将2mL2mol/L Fe2(SO4)3溶液加入有银镜的试管中 | 银镜减少但未消失 |
| Ⅲ | 将2mL 2mol/L FeCl3溶液加入有银镜的试管中 | 银镜较迅速消失 有白色沉淀生成 |
| A. | 方案Ⅰ说明Fe3+ 氧化了Ag | |
| B. | 方案Ⅱ涉及反应之一为Fe3++Ag?Fe2++Ag+ | |
| C. | 方案Ⅱ、Ⅲ对比说明SO42-比Cl-更易沉淀Ag+ | |
| D. | 三个方案对比说明方案Ⅰ是除去银镜的最佳方案 |
