题目内容
4.下列反应的离子方程式正确的是( )| A. | 碳酸钠的水解反应 CO32-+H2O→HCO3-+OH - | |
| B. | 碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3-+2OH-→CaCO3↓+2H2O+CO32- | |
| C. | 苯酚钠溶液与二氧化碳反应 C6H5O-+CO2+H2O→C6H5OH+CO32- | |
| D. | 稀硝酸与过量的铁屑反应 3Fe+8H++2NO3-→3Fe3++2NO↑+4 H2O |
分析 A.碳酸根离子水解生成碳酸氢根离子和氢氧根离子,用可逆号;
B.氢氧化钠过量,反应生成碳酸钙、碳酸钠和水;
C.苯酚钠溶液与二氧化碳反应生成苯酚与碳酸氢钠;
D.Fe过量生成亚铁离子,电荷不守恒.
解答 解:A.碳酸钠的水解反应,离子方程式:CO32-+H2O?HCO3-+OH -,故A错误;
B.碳酸氢钙与过量的NaOH溶液反应,离子方程式:Ca2++2HCO3-+2OH-→CaCO3↓+2H2O+CO32-,故B正确;
C.苯酚钠溶液与二氧化碳反应,离子方程式:C6H5O-+CO2+H2O→C6H5OH+HCO3-,故C错误;
D.稀硝酸与过量的铁屑反应 3Fe+8H++2NO3-→3Fe2++2NO↑+4 H2O,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意掌握离子方程式的书写原则,如难溶物、弱电解质等需要保留化学式.

练习册系列答案
相关题目
15.某元素原子核内含有23个质子,则该元素基态原子内未成对的电子数为( )
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 5个 |
19.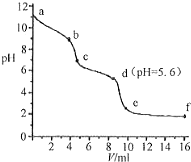 常温下,将已知浓度的盐酸滴定到未知浓度的Na2CO3溶液,用pH传感器测得混合溶液的pH变化曲线,如图所示:(已知饱和CO2溶液的pH为5.6)下列说法正确的是( )
常温下,将已知浓度的盐酸滴定到未知浓度的Na2CO3溶液,用pH传感器测得混合溶液的pH变化曲线,如图所示:(已知饱和CO2溶液的pH为5.6)下列说法正确的是( )
 常温下,将已知浓度的盐酸滴定到未知浓度的Na2CO3溶液,用pH传感器测得混合溶液的pH变化曲线,如图所示:(已知饱和CO2溶液的pH为5.6)下列说法正确的是( )
常温下,将已知浓度的盐酸滴定到未知浓度的Na2CO3溶液,用pH传感器测得混合溶液的pH变化曲线,如图所示:(已知饱和CO2溶液的pH为5.6)下列说法正确的是( )| A. | a点时,溶液呈碱性的原因是CO32-发生水解反应,其离子方程式为:CO32-+2H2O=H2CO3+2OH- | |
| B. | a→b段,溶液有气体放出 | |
| C. | c点以后,盐酸过量 | |
| D. | d点溶液中c(Na+)=c(Cl-) |
9.如表实验方案设计中,不能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 验证乙烯与溴发生加成反应 | 乙烯通入溴水中,测定反应前后溶液pH |
| B | 检验氯化铁溶液中是否含FeCl2 | 向氯化铁溶液中滴加铁氰化钾溶液 |
| C | 检验乙酸中是否混有乙醇 | 取样液于试管,加入一绿豆颗粒大的钠粒 |
| D | 验证Ksp(AgI)<Ksp(AgCl) | 向含等物质的量NaCl、KI的混合液中滴加AgNO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
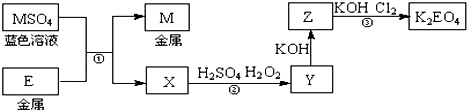
16. 已知电解熔融氧化钙可以得到金属钙和氯气,钙在氯气中燃烧又能生成氯化钙.请你根据已学知识,按图中箭头所表示的物质间可能发生的转化,分析下列说法正确的是( )
已知电解熔融氧化钙可以得到金属钙和氯气,钙在氯气中燃烧又能生成氯化钙.请你根据已学知识,按图中箭头所表示的物质间可能发生的转化,分析下列说法正确的是( )
 已知电解熔融氧化钙可以得到金属钙和氯气,钙在氯气中燃烧又能生成氯化钙.请你根据已学知识,按图中箭头所表示的物质间可能发生的转化,分析下列说法正确的是( )
已知电解熔融氧化钙可以得到金属钙和氯气,钙在氯气中燃烧又能生成氯化钙.请你根据已学知识,按图中箭头所表示的物质间可能发生的转化,分析下列说法正确的是( )| A. | CaO、Ca(OH)2、CaCO3三者都是离子化合物,在固态时可以导电 | |
| B. | 工业上也可用电解熔融氧化钙的方法制备金属钙 | |
| C. | 往Ca(OH)2溶液中滴加Na2CO3溶液或NaHCO3溶液,都能实现⑥的转化 | |
| D. | 工业上以氯气和石灰乳为原料通过反应制造主要成分为CaCl2的漂白粉 |
11.下列关于有机化合物的说法正确的是( )
| A. | 戊烷有两种同分异构体 | |
| B. | 乙烷,乙醇和苯均不能使酸性高锰酸钾褪色 | |
| C. | 乙醇,乙酸和乙酸乙酯可用碳酸钠溶液加以区别 | |
| D. | 乙烯,聚氯乙烯和苯分子均含有碳碳双键 |
 L B.
L B. L C.
L C. L D.
L D. L
L .
. .
.