题目内容
7.将一定量铁粉和铜粉的混合物加入由稀硫酸和稀硝酸组成的混合溶液中,充分反应后金属粉末有剩余,下列有关推断正确的是( )| A. | 反应过程中不可能产生H2 | |
| B. | 剩余的金属粉末中一定有铜 | |
| C. | 往反应后的溶液中加入KSCN 溶液会变血红色 | |
| D. | 往反应后的溶液中加入足量的稀H2SO4,则金属粉末的质量一定会减少 |
分析 铁比铜活泼,将一定量铁粉和铜粉的混合物加入由稀H2SO4和HNO3组成的混合溶液中,首先是较活泼的铁与酸溶液反应,当铁完全反应后,且溶液中存在:H+、(Fe3+)、NO3-时,铜溶解,所以剩余金属可能为铁或铁与铜的混合物,由于发生:Fe+2Fe3+=3Fe2+,Cu+2Fe3+=2Fe2++Cu2+,则当金属粉末有剩余,溶液中不存在Fe3+,当溶液中NO3-完全消耗时,加入硫酸,金属不再溶解,据此进行判断.
解答 解:A.铁比铜活泼,硝酸氧化性大于硫酸,将一定量铁粉和铜粉的混合物加入由稀H2SO4和HNO3组成的混合溶液中,首先是较活泼的铁与在酸性条件下与NO3-反应,当溶液中NO3-完全消耗时,铁和H+反应生成H2,故A错误;
B.铁比铜活泼,将一定量铁粉和铜粉的混合物加入由稀H2SO4和HNO3组成的混合溶液中,首先是较活泼的铁与酸溶液反应,当铁完全反应后,且溶液中存在:H+、(Fe3+)、NO3-时,铜溶解,所以剩余金属可能为 铜或铁与铜的混合物,所以剩余金属一定含有铜,故B正确;
C.由于发生:Fe+2Fe3+=3Fe2+,Cu+2Fe3+=2Fe2++Cu2+,则当金属粉末有剩余,溶液中不存在Fe3+,加入KSCN溶液不一定变成血红色,故C错误;
D.当剩余金属为铜时,且溶液中NO3-完全消耗时,加入硫酸,金属不再溶解,故D错误;
故选B.
点评 本题考查金属的活泼性比较以及硝酸的化学性质,题目难度中等,明确发生反应的先后顺序为解答关键,易错点为A、D,注意把握金属的活泼性强弱以及NO3-的性质,试题侧重考查学生的分析、理解能力.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
18.配置240mL1.84mol•L-1稀硫酸,下列操作正确的是( )
| A. | 将蒸馏水缓慢注入盛有一定量浓硫酸的烧杯中,并不断搅拌至冷却 | |
| B. | 必须的定量仪器有100mL量筒、250mL容量瓶和托盘天平 | |
| C. | 量取质量分数为98%的浓硫酸(ρ=1.84g•cm-3)的体积为25.0mL | |
| D. | 先在容量瓶中加入适量水,将量好的浓硫酸注入容器瓶加入定容 |
19.工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2.在该反应中( )
| A. | 硫元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1molNa2S2O3,转移4mol电子 | |
| D. | 相同条件下,每吸收10m3SO2就会放出2.5m3CO2 |
2.下列关于催化剂的说法错误的是( )
| A. | 温度越高,催化剂的催化效果越好 | |
| B. | 汽车排气管上的“催化转化器”能减少有害气体排放 | |
| C. | 催化剂可以改变化学反应速率,但不能破坏化学平衡 | |
| D. | 催化剂可以改变化学反应路径,且反应前后其质量和化学性质都不发生变化 |
19.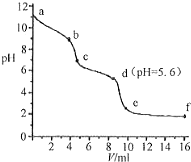 常温下,将已知浓度的盐酸滴定到未知浓度的Na2CO3溶液,用pH传感器测得混合溶液的pH变化曲线,如图所示:(已知饱和CO2溶液的pH为5.6)下列说法正确的是( )
常温下,将已知浓度的盐酸滴定到未知浓度的Na2CO3溶液,用pH传感器测得混合溶液的pH变化曲线,如图所示:(已知饱和CO2溶液的pH为5.6)下列说法正确的是( )
 常温下,将已知浓度的盐酸滴定到未知浓度的Na2CO3溶液,用pH传感器测得混合溶液的pH变化曲线,如图所示:(已知饱和CO2溶液的pH为5.6)下列说法正确的是( )
常温下,将已知浓度的盐酸滴定到未知浓度的Na2CO3溶液,用pH传感器测得混合溶液的pH变化曲线,如图所示:(已知饱和CO2溶液的pH为5.6)下列说法正确的是( )| A. | a点时,溶液呈碱性的原因是CO32-发生水解反应,其离子方程式为:CO32-+2H2O=H2CO3+2OH- | |
| B. | a→b段,溶液有气体放出 | |
| C. | c点以后,盐酸过量 | |
| D. | d点溶液中c(Na+)=c(Cl-) |
16. 已知电解熔融氧化钙可以得到金属钙和氯气,钙在氯气中燃烧又能生成氯化钙.请你根据已学知识,按图中箭头所表示的物质间可能发生的转化,分析下列说法正确的是( )
已知电解熔融氧化钙可以得到金属钙和氯气,钙在氯气中燃烧又能生成氯化钙.请你根据已学知识,按图中箭头所表示的物质间可能发生的转化,分析下列说法正确的是( )
 已知电解熔融氧化钙可以得到金属钙和氯气,钙在氯气中燃烧又能生成氯化钙.请你根据已学知识,按图中箭头所表示的物质间可能发生的转化,分析下列说法正确的是( )
已知电解熔融氧化钙可以得到金属钙和氯气,钙在氯气中燃烧又能生成氯化钙.请你根据已学知识,按图中箭头所表示的物质间可能发生的转化,分析下列说法正确的是( )| A. | CaO、Ca(OH)2、CaCO3三者都是离子化合物,在固态时可以导电 | |
| B. | 工业上也可用电解熔融氧化钙的方法制备金属钙 | |
| C. | 往Ca(OH)2溶液中滴加Na2CO3溶液或NaHCO3溶液,都能实现⑥的转化 | |
| D. | 工业上以氯气和石灰乳为原料通过反应制造主要成分为CaCl2的漂白粉 |
14.关于反应:
①2C2H2(g)+5O2(g)=4CO2 (g)+2H2O(l)△H=-2600kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1
③CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+216kJ•mol-1下列叙述正确的是( )
①2C2H2(g)+5O2(g)=4CO2 (g)+2H2O(l)△H=-2600kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1
③CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+216kJ•mol-1下列叙述正确的是( )
| A. | 2C2H2(g)+3O2(g)=4CO (g)+2H2O(l)△H=+1468 kJ•mol-1 | |
| B. | 在③反应时,若加入催化剂,可以使△H减小 | |
| C. | 若有3.2g CH4与足量水蒸汽按③反应,则放出热量是43.2 kJ | |
| D. | 若生成相同质量的CO2,则放出的热量C2H2大于CO |
 L B.
L B. L C.
L C. L D.
L D. L
L .
. .
.