题目内容
15.(1)取少量Fe2O3粉末(红棕色)加入适量盐酸,所发生反应的离子方程式为Fe2O3+6H+═2Fe3++3H2O,用所得溶液进行以下实验:(2)取少量溶液置于试管中,滴入NaOH溶液,可观察到有红褐色沉淀生成,反应的离子方程式为Fe3++3OH-═Fe(OH)3↓.
(3)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴FeCl3溶液,继续煮沸直至溶液呈红棕色,即可制得Fe(OH)3胶体.
(4)另取一小烧杯也加入20mL蒸馏水,向烧杯中加入1mL FeCl3溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到乙烧杯中的液体产生丁达尔效应.
分析 (1)氧化铁和稀盐酸反应生成铁离子和水;
(2)氢氧化钠和铁离子反应生成红褐色氢氧化铁沉淀;
(3)氢氧化铁胶体呈红棕色;
(4)胶体具有丁达尔效应.
解答 解:(1)氧化铁和稀盐酸反应生成铁离子和水,离子方程式为Fe2O3+6H+═2Fe3++3H2O,故答案为:Fe2O3+6H+═2Fe3++3H2O;
(2)氢氧化钠和铁离子反应生成红褐色氢氧化铁沉淀,离子方程式为Fe3++3OH-═Fe(OH)3↓,故答案为:Fe3++3OH-═Fe(OH)3↓;
(3)氢氧化铁胶体呈红棕色,所以看到的现象是液体呈红棕色,故答案为:红棕;
(4)胶体的微粒直径在1-100nm之间,具有丁达尔效应,乙是胶体,所以乙产生丁达尔效应,故答案为:乙.
点评 本题考查离子方程式的书写及胶体性质,为高频考点,明确离子方程式书写规则是解本题关键,注意要遵循原子守恒和电荷守恒,可以利用丁达尔效应检验胶体.

练习册系列答案
相关题目
5.一定浓度200mL的HNO3溶液中加入5.6g Fe,全部溶解,得到标准状况下的NO气体2.24L,测得反应后溶液中的c(H+)=0.1mol/L.若反应前后溶液体积变化忽略不计,则下列有关判断正确的是( )
| A. | 反应前HNO3溶液的浓度为2.0mol•L-1 | |
| B. | 反应后溶液中含硝酸亚铁 | |
| C. | 反应后的溶液最多还能溶解3.22g Fe | |
| D. | 反应后溶液中c(NO3-)=1.5mol•L-1 |
3.某酸式盐NaHY的水溶液中存在c(OH-)>c(H+),则下列叙述正确的是( )
| A. | H2Y的电离方程式:H2Y?2H++Y2- | |
| B. | HY-的水解方程式:HY-+H2O?H3O++Y2- | |
| C. | 该酸式盐溶液中粒子浓度关系:c(Na+)>c(HY-)>c(OH-)>c(H2Y)>c(H+) | |
| D. | 该酸式盐溶液中离子浓度关系:c(Na+)>c(Y2-)>c(HY-) |
4.下列关于混合物分离的方法中,能够分离汽油和水的是( )
| A. | 分液 | B. | 萃取 | C. | 蒸馏 | D. | 过滤 |
5.下列叙述正确的是( )
| A. | Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物 | |
| B. | Na2CO3不能转化成NaHCO3,而NaHCO3能转化成Na2CO3 | |
| C. | 与相同浓度的酸反应的速率:Na2CO3<NaHCO3 | |
| D. | Na着火时可用泡沫灭火器灭火 |

 、
、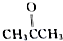 及
及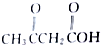 .根据上述事实推测A可能的构造式.
.根据上述事实推测A可能的构造式.