题目内容
5.一定浓度200mL的HNO3溶液中加入5.6g Fe,全部溶解,得到标准状况下的NO气体2.24L,测得反应后溶液中的c(H+)=0.1mol/L.若反应前后溶液体积变化忽略不计,则下列有关判断正确的是( )| A. | 反应前HNO3溶液的浓度为2.0mol•L-1 | |
| B. | 反应后溶液中含硝酸亚铁 | |
| C. | 反应后的溶液最多还能溶解3.22g Fe | |
| D. | 反应后溶液中c(NO3-)=1.5mol•L-1 |
分析 n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,n(NO)=$\frac{2.24L}{22.4L/mol}$=0.1mol,反应后溶液中的c(H+)=0.1mol/L,说明溶液中硝酸过量,
B.少量铁和稀硝酸反应生成硝酸铁;
A.根据氮原子守恒计算原溶液中硝酸的浓度;
D.根据电荷守恒确定硝酸根离子浓度;
C.反应后的溶液中硝酸与硝酸铁中含NO3-,结合3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O计算最多消耗的Fe.
解答 解:n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,n(NO)=$\frac{2.24L}{22.4L/mol}$=0.1mol,反应后溶液中的c(H+)=0.1mol/L,说明溶液中硝酸过量,
A.根据氮原子守恒得原溶液中n(HNO3)=n(NO)+3n[Fe(NO3)3]+n(HNO3)(剩余)=0.1mol+3×0.1mol+0.1mol/L×0.2L=0.42mol,
则原来硝酸的浓度=$\frac{0.42mol}{0.2L}$=2.1mol/L,故A错误;
B.铁和过量硝酸反应生成硝酸铁,故B错误;
C.原硝酸的物质的量=0.42mol,由3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O可知,最多消耗Fe为0.42mol×$\frac{3}{8}$×56=8.82g,则还能溶解8.82g-5.6=3.22g,故C正确;
D.根据电荷守恒得c(NO3-)=3c(Fe3+)+c(H+)=3×$\frac{0.1mol}{0.2L}$+0.1mol/L=1.6mol/L,故D错误;
故选C.
点评 本题考查氧化还原反应的计算,明确硝酸剩余发生的化学反应及最多溶解铁发生的化学反应是解答本题的关键,注意利用原子守恒计算原来硝酸浓度,选项D为解答的难点,题目难度中等.

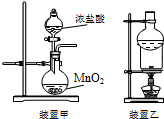
| A. | 用装置甲可以制备氯气 | |
| B. | 用装置乙分离泥沙中的碘单质 | |
| C. | 向碘酒中加入CCl4,静置后分液,可以分离碘酒中的碘 | |
| D. | 用玻璃棒蘸取NaClO溶液点在pH试纸上,测定溶液的pH |
| A. | 电离方程式:Na2SO4═Na2++SO42- | B. | 氯化钠的电子式: | ||
| C. | 14C的原子结构示意图: | D. | CH4分子的比例模型: |
| A. | 医用碘酒:人体补碘 | B. | 阿司匹林:消炎抗菌 | ||
| C. | 青霉素:解热镇痛 | D. | 氢氧化铝:中和过多胃酸 |
| 选项 | 目的 | 分离方法 | 原理 |
| A | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
| B | 氯气中混有氯化氢气体 | 洗气 | 氯气和氯化氢在饱和食盐水中溶解度不同 |
| C | 除去苏打中少量小苏打 | 加热 | 二者的溶解度不同 |
| D | 分离CCl4和碘的混合溶液 | 升华 | CCl4和碘沸点相差较大 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 3.0×1023 | B. | 3.0×1024 | C. | 7.5×1022 | D. | 7.5×1023 |

