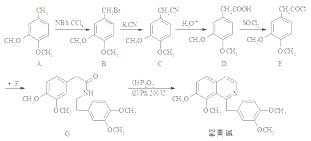
题目内容
【题目】为测定某血液样品中钙离子的含量,可取该样品2.00mL用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用1.000×10-4molL-1酸性KMnO4标准溶液滴定,到达终点时用去20.00mL标准液。则下列说法中错误的是( )
A.用酸性KMnO4(aq)滴定H2C2O4(aq)的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
B.KMnO4标准溶液应用碱式滴定管盛装
C.滴定终点时的现象为:最后1滴标准KMnO4(aq)使锥形瓶中溶液由无色变为浅紫色,且约半分钟内不褪色
D.经计算该样品中钙离子浓度为1.000×10-4gmL-1
【答案】B
【解析】
A.高锰酸钾具有强氧化性,在硫酸条件下将![]() 氧化为
氧化为![]() ,自身被还原为
,自身被还原为![]() ,反应方程式为
,反应方程式为![]() ,故A正确;
,故A正确;
B.高锰酸钾是强氧化剂,所以存放在酸式滴定管中,而不是碱式滴定管,故B错误;
C.滴定终点时溶液由无色变为浅紫色,所以滴定终点时的现象为:最后1滴标准![]() 使锥形瓶中溶液由无色变为浅紫色,且约半分钟内不褪色,故C正确;
使锥形瓶中溶液由无色变为浅紫色,且约半分钟内不褪色,故C正确;
D.由![]() 、
、![]() 可以得出关系式:
可以得出关系式:![]() ,所以
,所以![]() ,所以可计算出2mL该血液中含钙的质量为
,所以可计算出2mL该血液中含钙的质量为![]() ,1mL该血液中含钙:
,1mL该血液中含钙:![]()
![]() ,故D正确;
,故D正确;
故答案为B。

 阅读快车系列答案
阅读快车系列答案【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%