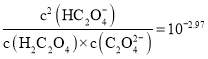ЬтФПФкШн
ЁОЬтФПЁПЖўСђЛЏют(MoS2ЃЌ ЦфжаMoЕФЛЏКЯМлЮЊ+4)БЛгўЮЊЁАЙЬЬхШѓЛЌМСжЎЭѕЁБЃЌРћгУЕЭЦЗжЪЕФЛдютПѓ(КЌMoS2ЁЂSiO2 вдМАCuFeS2ЕШдгжЪ)жЦБИИпДПЖўСђЛЏютЕФвЛжжЩњВњЙЄвеШчЯТЃК

ЛиД№ЯТСаЮЪЬтЃК
(1)ЁАЫсНўЁБжаМгШыЧтЗњЫсЪЧЮЊСЫГ§ШЅдгжЪSiO2ЃЌИУЗДгІЕФЛЏбЇЗНГЬЪНЮЊ___________ЁЃ
(2)дкЁАбѕЛЏБКЩеЁБЙ§ГЬжажївЊЪЧНЋMoS2зЊЛЏЮЊMoO3ЃЌдкИУЗДгІжабѕЛЏМСгыЛЙдМСЕФЮяжЪЕФСПжЎБШЮЊ________ЁЃ
(3)ШєбѕЛЏБКЩеВњЮяВњЩњЩеНсЯжЯѓЃЌдкЁААБНўЁБЧАЛЙашНјааЗлЫщДІРэЃЌЦфФПЕФЪЧ_________ЃЌЁААБНўЁБКѓЩњГЩ( NH4)2 MoO4ЗДгІЕФЛЏбЇЗНГЬЪНЮЊ___________ЁЃ
(4)ЯђЁААБНўЁБКѓЕФТЫвКжаМгШыNa2SКѓЃЌютЫсяЇзЊЛЏЮЊСђДњютЫсяЇ[(NH4)2MoS4]ЃЌМгШыбЮЫсКѓЃЌ(NH4)2 MoS4гыбЮЫсЗДгІЩњГЩMoS3ГСЕэЃЌГСЕэЗДгІЕФРызгЗНГЬЪНЮЊ_________________ЁЃ
(5)ИпДПMoS2жаШдШЛЛсДцдкМЋЮЂСПЕФЗЧећБШОЇЬхMoS2.8ЕШдгжЪЃЌдкИУдгжЪжаЮЊБЃГжЕчжаадЃЌMoдЊЫига+4ЁЂ+6СНжжМлЬЌЃЌдђMoS2жаMo4+ЫљеМMoдЊЫиЕФЮяжЪЕФСПЗжЪ§ ЮЊ__________ЁЃ
ЮЊ__________ЁЃ
(6)ютЫсФЦОЇЬх( Na2 MoO4 2H2O)ЪЧвЛжжЮоЙЋКІаЭРфШДЫЎЯЕЭГН№ЪєЛКЪДМСЃЌПЩвдгЩMoS2жЦБИЁЃдкжЦБИЙ§ГЬжаашМгШыBa(OH)2ЙЬЬхГ§ШЅSO42-ЃЌШєШмвКжаc(MoO42-)=0.4 mol/LЃЌc(SO42-)=0. 05 mol/LЃЌГЃЮТЯТЃЌЕБBaMoO4МДНЋПЊЪМГСЕэЪБЃЌSO42-ЕФШЅГ§ТЪЮЊ____________ [КіТдШмвКЬхЛ§БфЛЏЁЃвбжЊЃК259ЁцЃЌKsp( BaMoO4)=4.0ЁС10-8 ЃЌ Ksp(BaSO4)=1.1ЁС10-10]ЁЃ
ЁОД№АИЁПSiO2+4HF=SiF4Ёќ+2H2O 7ЃК2 діДѓЗДгІЮяЕФНгДЅУцЛ§ЃЌЬсИпНўГіЫйТЪ MoO3+2NH3H2O=(NH4)2MoO4+H2O MoS42-+2H+=MoS3Ё§+H2SЁќ 1ЃК5 97.8%
ЁОНтЮіЁП
(1)SiO2гыHFЗДгІВњЩњSiF4ЁЂH2OЃЛ
(2)ИпЮТБКЩеЃЌMoS2гыO2ЗДгІВњЩњMoO3КЭSO2ЃЌНсКЯЕчзгЪиКуЁЂдзгЪиКуЪщаДЗДгІЗНГЬЪНЃЌШЛКѓИљОнбѕЛЏЛЙдЗДгІЙцТЩХаЖЯЮяжЪЕФзїгУМАЗДгІЪБЮяжЪЕФСПЙиЯЕЃЛ
(3)ЁАбѕЛЏХрЩеЁБНјааЁААБНўЁБЧАашЖдБКЩеЮяНјааЗлЫщЃЌФПЕФЪЧдіДѓЗДгІЮяЕФНгДЅУцЛ§ЃЌЪЙЗДгІГфЗжЃЌЬсИпНўГіЫйТЪЃЛАБНўКѓЩњГЩ(NH4)2MoO4ЭЌЪБВњЩњЫЎЃЌИУЗДгІЕФЛЏбЇЗНГЬЪНЪЧMoO3+2NH3H2O=(NH4)2MoO4+H2OЃЛ
(4)(NH4)2MoS4гыбЮЫсЗДгІЕУЕНMoS3ГСЕэКЭH2SЦјЬхЃЛ
(5)Щшдк1molЕФMoS2.8жаMo4+гыMo6+ЕФЮяжЪЕФСПЗжБ№ЪЧxКЭyЃЌИљОнжЪСПЪиКуКЭЛЏКЯЮяЛЏКЯМлЮЊ0СаЪНПЩЕУЃЛ
(6)ИљОнKsp( BaMoO4)=4.0ЁС10-8МАc(MoO42-)=0.4 mol/LМЦЫуаЮГЩBaMoO4ГСЕэЪБШмвКжаc(Ba2+)ЃЌдйНсКЯKsp(BaSO4)=1.1ЁС10-10МЦЫуШмвКжаc(SO42-)ЃЌзюКѓИљОнШЅГ§ТЪКЌвхМЦЫуSO42-ЕФШЅГ§ТЪЃЛ
(1) дгжЪSiO2гыЧтЗњЫсЗДгІВњЩњSiF4ЁЂH2OЃЌЗДгІЗНГЬЪНЮЊSiO2+4HF=SiF4Ёќ+2H2OЃЛ
(2)ИпЮТБКЩеЃЌMoS2гыO2ЗДгІВњЩњMoO3КЭSO2ЃЌЗДгІЗНГЬЪНЮЊЃК2MoS2+7O2![]() 2MoO3+4SO2ЃЌдкИУЗДгІжаMoЁЂSдЊЫиЛЏКЯМлЩ§ИпЃЌЪЇШЅЕчзгЃЌЫљвдMoS2зїЛЙдМСЃЌOдЊЫиЛЏКЯМлНЕЕЭЃЌЛёЕУЕчзгЃЌБЛЛЙдЃЌO2зїбѕЛЏМСЃЌдђдкИУЗДгІжабѕЛЏМСгыЛЙдМСЕФЮяжЪЕФСПжЎБШЮЊ7ЃК2ЃЛ
2MoO3+4SO2ЃЌдкИУЗДгІжаMoЁЂSдЊЫиЛЏКЯМлЩ§ИпЃЌЪЇШЅЕчзгЃЌЫљвдMoS2зїЛЙдМСЃЌOдЊЫиЛЏКЯМлНЕЕЭЃЌЛёЕУЕчзгЃЌБЛЛЙдЃЌO2зїбѕЛЏМСЃЌдђдкИУЗДгІжабѕЛЏМСгыЛЙдМСЕФЮяжЪЕФСПжЎБШЮЊ7ЃК2ЃЛ
(3)ЁАбѕЛЏХрЩеЁБНјааЁААБНўЁБЧАашЖдБКЩеЮяНјааЗлЫщЃЌФПЕФЪЧдіДѓЗДгІЮяЕФНгДЅУцЛ§ЃЌЪЙЗДгІГфЗжЃЌЬсИпНўГіЫйТЪЃЛАБНўКѓЩњГЩ(NH4)2MoO4КЭH2OЃЌИУЗДгІЕФЛЏбЇЗНГЬЪНЪЧ
MoO3+2NH3H2O=(NH4)2MoO4+H2OЃЛ
(4)(NH4)2MoS4дкШмвКжагІИУЕчРыГіNH4+КЭMoS42-ЃЌMoS42-дкЫсадЛЗОГЯТЩњГЩMoS3ГСЕэЃЌСэЭтЕФЩњГЩЮяжЛФмЪЧH2SЦјЬхЃЌЫљвдРызгЗНГЬЪНЮЊЃКMoS42-+2H+=MoS3Ё§+H2SЁќЃЛ
(5)Щшдк1molЕФMoS2.8жаMo4+гыMo6+ЕФЮяжЪЕФСПЗжБ№ЪЧxКЭyЃЌдђx+y=1ЃЌИљОнЛЏКЯМлДњЪ§жЎКЭЮЊ0ЃЌдђга4x+6y=2.8ЁС2ЃЌНтЕУx=0.2ЃЌy=0.8ЃЌЫљвдИУдгжЪжаMo4+гыMo6+ЕФЮяжЪЕФСПжЎБШ =0.2ЃК(0.2+0.8)=1ЃК5ЃЛ
=0.2ЃК(0.2+0.8)=1ЃК5ЃЛ
(6)ЕБBaMoO4МДНЋПЊЪМГСЕэЪБЃЌШмвКжаc(Ba2+)=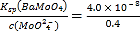 =1.0ЁС10-7mol/LЃЌгЩгкKsp(BaSO4)=1.1ЁС10-10ЃЌдђДЫЪБШмвКжаSO42-ЕФХЈЖШЮЊc(SO42-)=
=1.0ЁС10-7mol/LЃЌгЩгкKsp(BaSO4)=1.1ЁС10-10ЃЌдђДЫЪБШмвКжаSO42-ЕФХЈЖШЮЊc(SO42-)=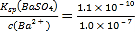 mol/L=1.1ЁС10-3mol/LЃЌЫљвдSO42-ЕФШЅГ§ТЪЮЊ
mol/L=1.1ЁС10-3mol/LЃЌЫљвдSO42-ЕФШЅГ§ТЪЮЊ![]() ЁС100%=97.8%ЁЃ
ЁС100%=97.8%ЁЃ

 Ш§аТПьГЕН№ХЦжмжмСЗЯЕСаД№АИ
Ш§аТПьГЕН№ХЦжмжмСЗЯЕСаД№АИЁОЬтФПЁП(1)дкЛЏбЇЗДгІжаЃЌжЛгаМЋЩйЪ§ФмСПБШЦНОљФмСПИпЕУЖрЕФЗДгІЮяЗжзгЗЂЩњХізВЪБВХПЩФмЗЂЩњЛЏбЇЗДгІЃЌетаЉЗжзгГЦЮЊЛюЛЏЗжзгЃЌЪЙЦеЭЈЗжзгБфГЩЛюЛЏЗжзгЫљашЬсЙЉЕФзюЕЭЯоЖШЕФФмСПНаЛюЛЏФмЃЌЦфЕЅЮЛЭЈГЃгУkJ/molБэЪОЁЃЧыШЯецЙлВьЭМЪОЃЌШЛКѓЛиД№ЮЪЬтЃК
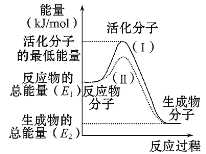
ЂйЭМжаЫљЪОЗДгІЪЧ_____(ЬюЁАЮќШШЁБЛђЁАЗХШШЁБ)ЗДгІЃЌИУЗДгІЕФІЄH=____ (гУКЌE1ЁЂE2ЕФДњЪ§ЪНБэЪО)ЁЃ
ЂкгЩЩЯЭМПЩжЊЧњЯпЂђНЯЧњЯпЂёЕЭЃЌетЪЧгЩгк________ЁЃ
(2)МзДММШЪЧживЊЕФЛЏЙЄдСЯ,гжПЩзїЮЊШМСЯЁЃРћгУКЯГЩЦј(жївЊГЩЗжЮЊCOЁЂCO2КЭH2)дкДпЛЏМСзїгУЯТКЯГЩМзДМ,ЗЂЩњЕФжївЊЗДгІШчЯТ:ЂйCO(g)+2H2(g)![]() CH3OH(g)ІЄH1 ЂкCO2(g)+3H2(g)
CH3OH(g)ІЄH1 ЂкCO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ІЄH2ЂлCO2(g)+H2(g)
CH3OH(g)+H2O(g)ІЄH2ЂлCO2(g)+H2(g)![]() CO(g)+H2O(g)ІЄH3ЁЃвбжЊЗДгІЂйжаЯрЙиЕФЛЏбЇМќМќФмЪ§ОнШчЯТ:
CO(g)+H2O(g)ІЄH3ЁЃвбжЊЗДгІЂйжаЯрЙиЕФЛЏбЇМќМќФмЪ§ОнШчЯТ:
ЛЏбЇМќ | H-H | C-O |
| H-O | C-H |
E/ kJЁЄmol-1 | 436 | 343 | 1076 | 465 | 413 |
гЩДЫМЦЫуІЄH1= _____kJЁЄmol-1ЃЛвбжЊІЄH2=Ѓ58 kJЁЄmol-1ЃЌдђІЄH3=___kJЁЄmol-1ЁЃ
ЁОЬтФПЁПМзДМЪЧживЊЕФЛЏбЇЙЄвЕЛљДЁдСЯКЭЧхНрвКЬхШМСЯЁЃвбжЊжЦБИМзДМЕФгаЙиЛЏбЇЗДгІвдМАдкВЛЭЌЮТЖШЯТЕФЛЏбЇЗДгІЦНКтГЃЪ§ШчЯТБэЫљЪОЃК
ЛЏбЇЗДгІ | ЦНКтГЃЪ§ | ЮТЖШ/Ёц | |
500 | 800 | ||
Ђй2H2(g)ЃЋCO(g) | K1 | 2.5 | 0.15 |
ЂкH2(g)ЃЋCO2(g) | K2 | 1.0 | 2.50 |
Ђл3H2(g)ЃЋCO2(g) | K3 | ||
ЃЈ1ЃЉОнЗДгІЂйгыЂкПЩЭЦЕМГіK1ЁЂK2гыK3жЎМфЕФЙиЯЕЃЌдђK3ЃН______(гУK1ЁЂK2БэЪО)ЁЃ
ЃЈ2ЃЉЗДгІЂлЕФІЄH____0(ЬюЁАЃОЁБЛђЁАЃМЁБ)ЁЃ
ЃЈ3ЃЉ500ЁцЪБВтЕУЗДгІЂлдкФГЪБПЬH2(g)ЁЂCO2(g)ЁЂCH3OH(g)ЁЂH2O(g)ЕФХЈЖШЯрЕШЃЌЧвОљЮЊ0.1molЁЄLЃ1ЃЌдђДЫЪБІде§____ІдФц(ЬюЁА>ЁБЁЂЁАЃНЁБЛђЁА<ЁБ)
ЃЈ4ЃЉФГЮТЖШЯТдк2LКуШнУмБеШнЦїжаМгШыCH3OHЗЂЩњЗДгІ2CH3OHЃЈgЃЉ![]() CH3OCH3ЃЈgЃЉ+H2OЃЈgЃЉЃЌВтЕУгаЙиЪ§ОнШчЯТЃК
CH3OCH3ЃЈgЃЉ+H2OЃЈgЃЉЃЌВтЕУгаЙиЪ§ОнШчЯТЃК
ЗДгІЪБМф/min | 0 | 1 | 2 | 3 | 4 |
nЃЈCH3OHЃЉ/mol | 1.02 | 0.42 | 0.22 | 0.02 | 0.02 |
ЂйЗДгІдк2minФквдCH3OCH3БэЪОЕФЛЏбЇЗДгІЫйТЪЮЊ____ЃЌ
ЂкИУЮТЖШЯТЕФЗДгІЕФЦНКтГЃЪ§ЮЊ____ЁЃ