题目内容
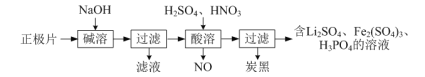
【题目】氮及其化合物的转化过程如图所示。下列分析合理的是

A.催化剂 a 表面发生了极性共价键的断裂和形成
B.N2 与 H2 反应生成 NH3 的原子利用率为 100%
C.催化剂 a、b 能提高反应的平衡转化率
D.在催化剂 b 表面 2.24 L NH3 反应生成 NO 转移电子数目为 0.5NA
【答案】B
【解析】
A. 根据图示,在催化剂a表面发生反应![]() ,催化剂 a 表面发生了非极性共价键的断裂和极性共价键的形成,故A错误;
,催化剂 a 表面发生了非极性共价键的断裂和极性共价键的形成,故A错误;
B. N2 与 H2 发生![]() 反应,N、H原子全部转移到产物 NH3 中,所以原子利用率为100%,故B正确;
反应,N、H原子全部转移到产物 NH3 中,所以原子利用率为100%,故B正确;
C. 催化剂不能使平衡发生移动,所以催化剂 a、b 不能提高反应的平衡转化率,故C错误;
D. 非标准状况,2.24 L NH3的物质的量不一定是0.1mol,所以在催化剂 b 表面 2.24 L NH3 反应生成 NO 转移电子数目不一定为 0.5NA,故D错误;
选B。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g),已知下列化学键的键能:
2NH3(g),已知下列化学键的键能:
化学键 | 键能kJ/mol |
H-H | 436 |
N-H | 391 |
N | 946 |
下列说法正确的是
A. 该反应为吸热反应B. 该反应中反应物的总能量高于生成物的总能量
C. 反应热ΔH=92 kJ·mol-1D. 生成1 mol NH3放出92 kJ热量