题目内容
【题目】碳和碳的化合物在人类生产、生活中的应用非常广泛。“低碳生活”不再只是一种理想,更是一种值得期待的生活方式。
(1)甲烷燃烧时放出大量的热,可作为能源应用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(1) △H1=-1214.6kJ/mol;
②2CO(g)+O2(g)=2CO2(g) △H2=-566kJ/mol;
则反应CH4(g)+2O2(g)==CO2(g)+2H2O(1)的△H=___。
(2)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是___。
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
起始量/mol | 平衡量/mol | |||||
实验组 | 温度/℃ | H2O | CO | CO2 | CO | 达到平衡所需时间/min |
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中,以v(H2)表示的平均反应速率为___;
②该反应的正反应为___ (填“吸”或“放”)热反应;
③若要实验3达到与实验2相同的平衡状态(即各物质的体积分数分别相等),则a、b应满足的关系是___(用含a、b的数学式表示)。
【答案】-890.3kJ/mol CH4-8e- +l0OH- =CO32- +7H2O 0.16mol·L-1·min-1 放 a∶b=1∶2(或b=2a)
【解析】
(1)利用盖斯定律,将(①+②)×![]() ,即得反应CH4(g)+2O2(g)==CO2(g)+2H2O(1)的△H。
,即得反应CH4(g)+2O2(g)==CO2(g)+2H2O(1)的△H。
(2)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极为CH4失电子的产物与OH-反应最终生成CO32-和水。
(3)①由反应式可以看出,生成H2的物质的量与CO2相同,根据速率计算公式可以计算出v(H2);
②通过表中两组数据求出不同温度下转化率,比较改变温度时转化率的变化判断化学平衡移动的方向,判断反应的热效应;
③根据等效平衡原理解答。
(1)①2CH4(g)+3O2(g)=2CO(g)+4H2O(1) △H1=-1214.6kJ/mol;
②2CO(g)+O2(g)=2CO2(g) △H2=-566kJ/mol;
利用盖斯定律,将(①+②)×![]() ,即得反应CH4(g)+2O2(g)==CO2(g)+2H2O(1)的△H=-890.3kJ/mol;
,即得反应CH4(g)+2O2(g)==CO2(g)+2H2O(1)的△H=-890.3kJ/mol;
故答案为:-890.3kJ/mol;
(2)负极为CH4失电子的产物与OH-反应最终生成CO32-和水,电极反应式为CH4-8e- +l0OH-=CO32-+7H2O;
故答案为:CH4-8e- +l0OH- =CO32-+7H2O;
(3)①由反应式可以看出,生成H2的物质的量与CO2相同,即为1.6mol,则实验1中,v(H2)=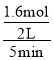 = 0.16mol·L-1·min-1;
= 0.16mol·L-1·min-1;
故答案为:0.16mol·L-1·min-1;
②实验1中CO的转化率为:![]() ×100%=40%,实验2中CO的转化率为:
×100%=40%,实验2中CO的转化率为:![]() ×100%=20%,温度升高,反应物转化率降低,平衡向逆向移动,逆向为吸热反应,所以正向为放热反应;
×100%=20%,温度升高,反应物转化率降低,平衡向逆向移动,逆向为吸热反应,所以正向为放热反应;
故答案为:放;
③若要实验3达到与实验2相同的平衡状态(即各物质的体积分数分别相等),因为反应3达平衡的时间短,反应速率快,反应3相当于反应2加压,但平衡不移动,所以a、b的比值不变,即a、b应满足的关系为a∶b=1∶2(或b=2a);
故答案为:a∶b=1∶2(或b=2a)。

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
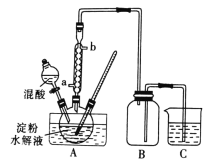
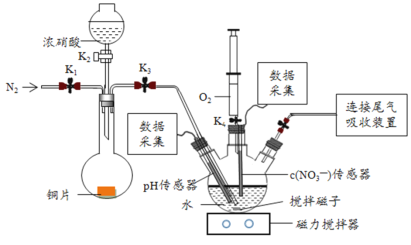
双基同步导航训练系列答案【题目】实验小组为验证NO2与水反应的产物,用如图所示装置进行实验(夹持装置已略去,气密性已检验)。
(实验过程)
实验步骤 | 实验现象 |
Ⅰ.打开K1、K3、K5,关闭K2、K4,通入一段时间N2,关闭K1 | —— |
Ⅱ.打开K2,放入足量浓HNO3,同时打开pH传感器和NO3-传感器,记录数据 | 圆底烧瓶中反应剧烈,铜片逐渐溶解,溶液变为蓝绿色, ;片刻后,三颈瓶内的导管口有气泡冒出 |
III.5min后,打开K4,用注射器将少量空气注入三颈瓶,关闭K4 | 三颈瓶内的气体从无色变为浅红棕色 |
步骤II中,传感器记录数据如图所示:
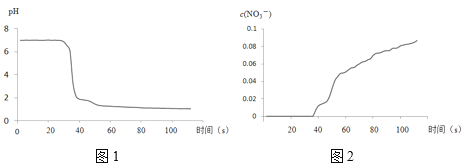
(解释及结论)
(1)NO2与水反应的离子方程式为___。
(2)步骤I中,通入N2的目的是___。
(3)将步骤II中圆底烧瓶内的实验现象补充完整:___。
(4)该实验验证NO2与水反应产物的实验证据包括___(填序号)。
A.圆底烧瓶中溶液变为蓝绿色
B.三颈瓶内的气体从无色变为浅红棕色
C.pH传感器记录所得数据
D.NO3-传感器记录所得数据
(5)有同学认为该实验不严谨,因为也可能导致传感器所记录的数据结果___。
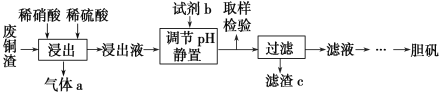
【题目】硫酸铜在生产、生活中应用广泛。某化工厂用含少量铁的废铜渣为原料生产胆矾的流程如下:
已知生成氢氧化物沉淀的pH如下表所示:
Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀 | 4.2 | 6.5 | 1.5 |
完全沉淀 | 6.7 | 9.7 | 3.7 |
(1)写出浸出时铜与稀硫酸、稀硝酸反应生成硫酸铜的化学方程式:________________。
(2)取样检验是为了确认Fe3+是否除净,你的检验方法是__________________________。
(3)试剂b是____________,滤渣c是______________(均写化学式)。
(4)气体a可以被循环利用,用化学方程式表示气体a被循环利用的原理为2NO+O2===2NO2、 __________________。
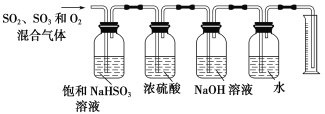
(5)一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,且n(SO3)∶n(SO2)=1∶2,写出硫酸铜受热分解的化学方程式:________________。
(6)某同学设计了如下图所示的实验装置分别测定生成的SO2、SO3气体的质量和O2气体的体积。此设计有不合理之处,请说明理由:______________。