题目内容
【题目】两个化学兴趣小组进行了以下探究活动:
第一组:为研究铁质材料与热浓硫酸的反应,称取铁钉(碳素钢)12.0g放入30.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。甲同学取672 mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4,然后加入足量BaCl2溶液,经适当操作后得到干燥固体4.66g。分析上述实验中SO2体积分数的结果。甲同学认为气体Y中还可能含有H2和CO2气体。为此设计了下列探究实验装置(图中夹持仪器省略)。

(1)写出产生CO2的化学方程式_____________。
(2)装置A中试剂的作用是______,反应的离子方程式________。
(3)如果气体Y中含有H2,预计实验现象应是____________。
(4)简述确认气体Y中含有CO2的实验现象__________。
第二组:拟用下列装置定量分析空气中SO2的含量:

(5)KMnO4溶液中导管末端做成球状多孔结构的作用是________。
(6)该实验中已经知道的数据有气体流速a L/min、酸性KMnO4溶液的体积b L,其浓度为c mol/L。若从气体通入到紫色恰好褪去,用时5分钟。则此次取样处的空气中二氧化硫含量为___g/L
【答案】C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O 除去混合气体中的SO2 5SO2+2
CO2↑+2SO2↑+2H2O 除去混合气体中的SO2 5SO2+2![]() +2H2O=5
+2H2O=5![]() +2Mn2++4H+ E中固体由黑变红和F中固体由白变蓝 B中品红不褪色且C中澄清石灰水变浑浊 增大接触面积,有利于SO2的充分吸收
+2Mn2++4H+ E中固体由黑变红和F中固体由白变蓝 B中品红不褪色且C中澄清石灰水变浑浊 增大接触面积,有利于SO2的充分吸收 ![]()
【解析】
第一组:气体Y中含有SO2,现欲探究气体Y中还可能含有H2和CO2气体,SO2和CO2都能使澄清石灰水变浑浊,但二氧化硫具有还原性,可与酸性高锰酸钾发生氧化还原反应,
则为排除SO2对CO2检验的干扰,先将气体Y通过酸性高锰酸钾溶液,从而除去SO2气体,品红溶液用于检验SO2是否除尽,澄清石灰水用于检验是否含有CO2气体,D装置用于干燥气体,同时会吸收未反应完的CO2气体,E、F用于检验氢气,G装置可防止空气中的水蒸气进入F中干扰实验,据此分析解答。
第二组:通入空气体积5a L,反应的KMnO4物质的量为bc mol,根据KMnO4物质的量运用方程式计算空气中二氧化硫的物质的量,进而计算空气中二氧化硫含量。
(1)铁钉(碳素钢)中含有碳单质,其与浓硫酸在加热的条件下可反应产生二氧化硫、二氧化碳和水,化学方程式为C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O;
(2)由上述分析知,装置A中酸性高锰酸钾溶液的作用是除去混合气体中的SO2,该反应为氧化还原反应,SO2被氧化为![]() ,
,![]() 被还原为Mn2+,根据得失电子守恒、电荷守恒、元素守恒配平该反应的离子方程式为5SO2+2
被还原为Mn2+,根据得失电子守恒、电荷守恒、元素守恒配平该反应的离子方程式为5SO2+2![]() +2H2O=5
+2H2O=5![]() +2Mn2++4H+;
+2Mn2++4H+;
(3)装置E、F用于检验氢气,氢气具有还原性,能还原黑色的氧化铜生成红色的铜单质,同时生成水,水能使无水硫酸铜变蓝色,这是检验水的特征反应,则如果气体Y中含有H2,预计实验现象应是E中固体由黑变红、F中固体由白变蓝;
(4)确认气体Y中含有CO2,应完全排除SO2的干扰,当B中品红溶液不褪色,C中澄清石灰水变浑浊,可说明含有CO2;
(5)KMnO4溶液中导管末端做成球状多孔结构的作用是增大接触面积,有利于SO2的充分吸收;
(6)通入空气的体积为a L/min×5min=5a L,KMnO4物质的量为b L×c mol/L=bc mol,根据5SO2+2![]() +2H2O=5
+2H2O=5![]() +2Mn2++4H+可得5SO2~2
+2Mn2++4H+可得5SO2~2![]() ,则n(SO2)=
,则n(SO2)=![]() ,m(SO2)=
,m(SO2)=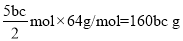 ,此次取样处的空气中二氧化硫含量为
,此次取样处的空气中二氧化硫含量为![]() 。
。

 名师点拨卷系列答案
名师点拨卷系列答案【题目】碳和碳的化合物在人类生产、生活中的应用非常广泛。“低碳生活”不再只是一种理想,更是一种值得期待的生活方式。
(1)甲烷燃烧时放出大量的热,可作为能源应用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(1) △H1=-1214.6kJ/mol;
②2CO(g)+O2(g)=2CO2(g) △H2=-566kJ/mol;
则反应CH4(g)+2O2(g)==CO2(g)+2H2O(1)的△H=___。
(2)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是___。
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
起始量/mol | 平衡量/mol | |||||
实验组 | 温度/℃ | H2O | CO | CO2 | CO | 达到平衡所需时间/min |
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中,以v(H2)表示的平均反应速率为___;
②该反应的正反应为___ (填“吸”或“放”)热反应;
③若要实验3达到与实验2相同的平衡状态(即各物质的体积分数分别相等),则a、b应满足的关系是___(用含a、b的数学式表示)。