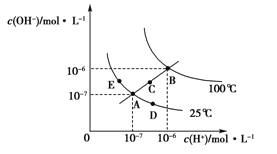
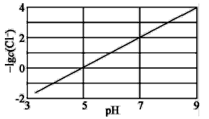
题目内容
【题目】今年是门捷列夫发现元素周期律151周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )

A.常温常压下,Y单质为固态
B.气态氢化物热稳定性:Z<W
C.原子半径:W<X
D.X的最高价氧化物的水化物是强碱
【答案】D
【解析】
W、X、Y、Z为短周期主族元素,依据它们在元素周期表的位置关系可以看出,W的族序数比X多2,因主族元素族序数在数值上等于该元素的最高价(除F与O以外),可设X的族序数为a,则W的族序数为a+2,W与X的最高化合价之和为8,则有a+(a+2)=8,解得a=3,故X位于第IIIA族,为Al元素;Y为Si元素,Z为P元素;W为N元素,据此分析作答。
根据上述分析可知W、X、Y、Z分别为N、Al、Si、P,
A. 常温常压下,Si单质为固体,A项正确;
B. 同一主族元素从上到下,元素非金属性依次减弱,气体氢化物的稳定性依次减弱,则气体氢化物的稳定性:PH3<NH3,B项正确;
C. 同一周期从左到右元素原子半径依次减小,同一主族从上到下元素原子半径依次增大,则原子半径比较:N<Al,C项正确;
D. X的最高价氧化物的水化物为氢氧化铝,其既可以和强酸反应,又可以与强碱反应,属于两性氢氧化物,D项错误;
答案选D。

【题目】碳和碳的化合物在人类生产、生活中的应用非常广泛。“低碳生活”不再只是一种理想,更是一种值得期待的生活方式。
(1)甲烷燃烧时放出大量的热,可作为能源应用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(1) △H1=-1214.6kJ/mol;
②2CO(g)+O2(g)=2CO2(g) △H2=-566kJ/mol;
则反应CH4(g)+2O2(g)==CO2(g)+2H2O(1)的△H=___。
(2)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是___。
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
起始量/mol | 平衡量/mol | |||||
实验组 | 温度/℃ | H2O | CO | CO2 | CO | 达到平衡所需时间/min |
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中,以v(H2)表示的平均反应速率为___;
②该反应的正反应为___ (填“吸”或“放”)热反应;
③若要实验3达到与实验2相同的平衡状态(即各物质的体积分数分别相等),则a、b应满足的关系是___(用含a、b的数学式表示)。