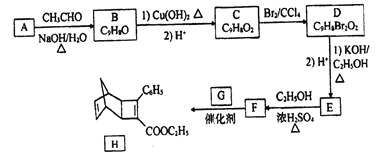
题目内容
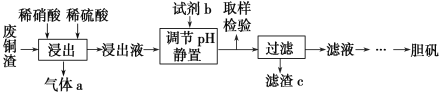
【题目】硫酸铜在生产、生活中应用广泛。某化工厂用含少量铁的废铜渣为原料生产胆矾的流程如下:
已知生成氢氧化物沉淀的pH如下表所示:
Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀 | 4.2 | 6.5 | 1.5 |
完全沉淀 | 6.7 | 9.7 | 3.7 |
(1)写出浸出时铜与稀硫酸、稀硝酸反应生成硫酸铜的化学方程式:________________。
(2)取样检验是为了确认Fe3+是否除净,你的检验方法是__________________________。
(3)试剂b是____________,滤渣c是______________(均写化学式)。
(4)气体a可以被循环利用,用化学方程式表示气体a被循环利用的原理为2NO+O2===2NO2、 __________________。
(5)一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,且n(SO3)∶n(SO2)=1∶2,写出硫酸铜受热分解的化学方程式:________________。
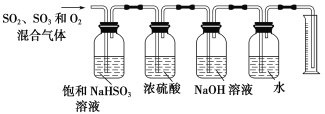
(6)某同学设计了如下图所示的实验装置分别测定生成的SO2、SO3气体的质量和O2气体的体积。此设计有不合理之处,请说明理由:______________。
【答案】3Cu + 2HNO3+ 3H2SO4=3CuSO4+ 2NO↑+ 4H2O; 向试样中滴加KSCN溶液,若溶液显红色,则Fe3+未除净,否则Fe3+除净; CuO或Cu (OH)2或CuCO3或Cu2(OH)2 CO3; Fe(OH)3; 3NO2+H2O=2HNO3+NO; 3CuSO4![]() 3CuO + SO3↑+ 2SO2↑+ O2↑; 混合气体通过饱和NaHSO3溶液,SO3被吸收生成硫酸,和NaHSO3反应生成SO2,没法确定SO3和SO2的质量,因此需要去掉盛饱和NaHSO3溶液的装置;此外排水量氧气的体积时,气体从短导管通入。
3CuO + SO3↑+ 2SO2↑+ O2↑; 混合气体通过饱和NaHSO3溶液,SO3被吸收生成硫酸,和NaHSO3反应生成SO2,没法确定SO3和SO2的质量,因此需要去掉盛饱和NaHSO3溶液的装置;此外排水量氧气的体积时,气体从短导管通入。
【解析】
含少量铁的废铜渣先经稀硫酸、稀硝酸反应生成硫酸铜和硫酸铁,再加入CuO或Cu (OH)2或CuCO3或Cu2(OH)2 CO3调节溶液PH,使生成Fe(OH)3沉淀,滤液再进行蒸发浓缩、冷却结晶、过滤、洗涤、干燥可得到胆矾。
(1)铜与稀硫酸、稀硝酸的混合液反应生成硫酸铜,而为了不残留NO3-的杂质,NO3-要全部转化为NO。根据得失电子守恒,1molCu失去2mol电子,生成硫酸铜,1molNO3-得到3mol电子生成NO,得失电子守恒,则CuSO4和NO的比例为3:2,根据原子守恒配平,化学方程式为3Cu + 2HNO3+ 3H2SO4=3CuSO4+ 2NO↑+ 4H2O;
(2)Fe3+的检验方法是:向试样中滴加KSCN溶液,若溶液显红色,则Fe3+未除净,否则Fe3+除净;
(3)废铜渣中含有杂质铁,所以调节pH目的是促进Fe3+水解,生成Fe(OH)3沉淀,从而与CuSO4分离;,则滤渣c是Fe(OH)3;
(4)气体a是NO,NO与氧气反应生成二氧化氮,二氧化氮溶于水又得硝酸和NO,化学方程式为3NO2+H2O=2HNO3+NO;
(5)硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,其中n(SO3)∶n(SO2)=1∶2,物质的量之比,等于化学计量数之比,根据得失电子守恒和原子守恒配平方程式得3CuSO4![]() 3CuO + SO3↑+ 2SO2↑+ O2↑;
3CuO + SO3↑+ 2SO2↑+ O2↑;
(6)SO3气体可溶解于浓硫酸中,采用98.3%的浓硫酸吸收SO3气体,SO2气体用碱液吸收,氧气用排水法测量,混合气体通过饱和NaHSO3溶液,SO3被吸收生成硫酸,和NaHSO3反应生成SO2,没法确定SO3的质量,此外排水测氧气体积时,气体应该从短导管进入,而水从长导管被气体压入量筒中。答案为混合气体通过饱和NaHSO3溶液,SO3被吸收生成硫酸,和NaHSO3反应生成SO2,没法确定SO3和SO2的质量,因此需要去掉盛饱和NaHSO3溶液的装置;此外排水量氧气的体积时,气体从短导管通入。

【题目】碳和碳的化合物在人类生产、生活中的应用非常广泛。“低碳生活”不再只是一种理想,更是一种值得期待的生活方式。
(1)甲烷燃烧时放出大量的热,可作为能源应用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(1) △H1=-1214.6kJ/mol;
②2CO(g)+O2(g)=2CO2(g) △H2=-566kJ/mol;
则反应CH4(g)+2O2(g)==CO2(g)+2H2O(1)的△H=___。
(2)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是___。
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
起始量/mol | 平衡量/mol | |||||
实验组 | 温度/℃ | H2O | CO | CO2 | CO | 达到平衡所需时间/min |
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中,以v(H2)表示的平均反应速率为___;
②该反应的正反应为___ (填“吸”或“放”)热反应;
③若要实验3达到与实验2相同的平衡状态(即各物质的体积分数分别相等),则a、b应满足的关系是___(用含a、b的数学式表示)。