题目内容
【题目】草酸(乙二酸)存在于自然界的植物中,草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,175℃时分解。
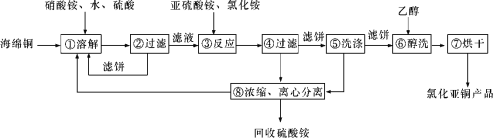
Ⅰ.用硝酸氧化法制备草酸晶体并测定其纯度,制备装置如图所示(加热、固定等装置略去)。
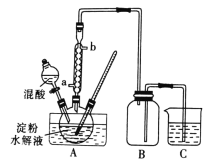
实验步骤如下
①糖化:先将淀粉水解为葡萄糖;
②氧化:在淀粉水解液中加入混酸(质量之比为3:2的65%HNO3与98%H2SO4的混合物),在55~60℃下水浴加热发生反应;
③结晶、蒸发、干燥:反应后溶液经冷却、减压过滤,即得草酸晶体粗产品。
(1)装混酸的仪器名称为________;步骤②中,水浴加热的优点为___________________。
(2)“②氧化”时发生的主要反应如下,完成下列化学方程式:
___C6H12O6 + ___HNO3![]() ____+__________H2C2O4 + 9NO2↑ + 3NO↑+ ______。
____+__________H2C2O4 + 9NO2↑ + 3NO↑+ ______。
(3)称取m g草酸晶体粗产品,配成100 mL溶液。取20.00 mL于锥形瓶中,用a moL·L-1KMnO4标准液标定,只发生5H2C2O4 + 2MnO4- + 6H+ = 2Mn2+ + 10CO2↑ + 8H2O反应,消耗KMnO4标准液体积为VmL,则所得草酸晶体(H2C2O4·2H2O)的纯度为___________。
Ⅱ.证明草酸晶体分解得到的产物
(4)甲同学选择上述装置验证产物CO2,装置B的主要作用是__________。
(5)乙同学认为草酸晶体分解的产物中除了CO2、H2O应该还有CO,为进行验证,选用甲同学实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验。
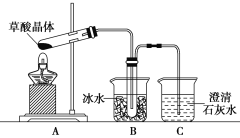
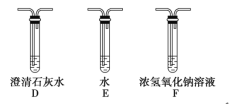
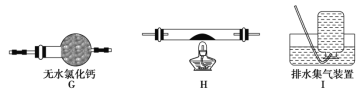
①乙同学的实验装置中,依次连接的合理顺序为A、B、_____________。其中装置H反应管中盛有的物质是________________________。
②能证明草酸晶体分解产物中有CO的现象是_____________________。
【答案】分液漏斗 使受热均匀,便于控制温度 1 12 3 9 9H2O ![]() 使升华的草酸冷凝,避免对CO2检验的干扰 FDGHDI CuO H中黑色固体变红色,第一个D装置无现象,第二个D装置出现白色浑浊,即可证明
使升华的草酸冷凝,避免对CO2检验的干扰 FDGHDI CuO H中黑色固体变红色,第一个D装置无现象,第二个D装置出现白色浑浊,即可证明
【解析】
(1)根据仪器构造可知装混酸的仪器为分液漏斗;水浴加热的优点为:使受热均匀,便于控制温度,故答案为:分液漏斗;使受热均匀,便于控制温度;
(2)反应中碳元素化合价0价升高为+3价,电子转移18个,氮元素化合价+5价降低到+4价,电子转移1个,降低到+2价电子转移3个,结合化学方程式中系数和电子守恒和原子守恒配平的化学方程式:![]() ,故答案为:1;12;3;9;9H2O;
,故答案为:1;12;3;9;9H2O;
(3)称取mg草酸晶体粗产品,配成100mL溶液,取20.00mL于锥形瓶中,用amoLL1KMnO4标准液标定,只发生5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O反应,消耗KMnO4标准液体积为VmL,100mL溶液中含草酸物质的量![]() ,则所得草酸晶体(H2C2O42H2O)的纯度=
,则所得草酸晶体(H2C2O42H2O)的纯度=![]() ,故答案为:
,故答案为:![]() ;
;
(4)草酸易挥发,导致生成的气体中含有草酸,草酸和氢氧化钙反应生成难溶性的草酸钙而干扰二氧化碳的检验,B装置温度较低,使升华的草酸冷凝,防止干扰二氧化碳的检验,故答案为:使升华的草酸冷凝,避免对CO2检验的干扰;
(5)①要检验生成CO,在甲组实验后,用浓氢氧化钠除去二氧化碳,用澄清石灰水检验二氧化碳,用碱石灰干燥CO,利用CO和CuO发生还原反应生成CO2,再利用澄清石灰水检验生成的二氧化碳,用排水法收集CO避免环境污染,I中集气瓶收集到的气体主要是CO,所以其连接顺序是ABFDGHDI;H装置中盛放的物质应该具有氧化性,且和CO反应有明显现象发生,CuO能被CO还原且反应过程中黑色固体变为红色,现象明显,所以H中盛放的物质是CuO,故答案为:FDGHDI;CuO;
②CO具有还原性,其氧化产物是二氧化碳,二氧化碳能使澄清石灰水变浑浊,且CO将黑色的CuO还原为红色的Cu,只要H中黑色固体转化为红色且第一个D装置无现象,第二个D装置出现白色浑浊就说明含有CO,故答案为:H中黑色固体变红色,第一个D装置无现象,第二个D装置出现白色浑浊,即可证明。

【题目】碳和碳的化合物在人类生产、生活中的应用非常广泛。“低碳生活”不再只是一种理想,更是一种值得期待的生活方式。
(1)甲烷燃烧时放出大量的热,可作为能源应用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(1) △H1=-1214.6kJ/mol;
②2CO(g)+O2(g)=2CO2(g) △H2=-566kJ/mol;
则反应CH4(g)+2O2(g)==CO2(g)+2H2O(1)的△H=___。
(2)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是___。
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
起始量/mol | 平衡量/mol | |||||
实验组 | 温度/℃ | H2O | CO | CO2 | CO | 达到平衡所需时间/min |
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中,以v(H2)表示的平均反应速率为___;
②该反应的正反应为___ (填“吸”或“放”)热反应;
③若要实验3达到与实验2相同的平衡状态(即各物质的体积分数分别相等),则a、b应满足的关系是___(用含a、b的数学式表示)。