题目内容
【题目】利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理。
某工厂对制革工业污泥中Cr元素的回收与再利用工艺如图(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | - | - | - |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 9(>9溶解) |
(1) 酸浸时,为了提高浸取率可采取的措施是____(至少写两条)。
(2)H2O2的作用是_____。
(3)调pH=8是为了除去___(填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(4)钠离子交换树脂的原理为Mn++nNaR→MRn+nNa+,被交换的杂质离子是___(填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(5)已知以下氧化还原反应方程式(未配平):Na2Cr2O7+SO2+H2O=Cr(OH)(H2O)5SO4+Na2SO4;以上反应各物质的配平系数依次为___。每生成1 mol Cr(OH)(H2O)5SO4转移电子的数目为___。
【答案】升高温度、搅拌、过滤后再向滤渣中加入硫酸(多次浸取)、适当延长浸取时间 将Fe2+和Cr3+氧化 Fe3+、Al3+ Mg2+、Ca2+ 1、3、11、2、1 3NA
【解析】
硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+,过滤后向滤液中加入双氧水,双氧水有强氧化性,能氧化还原性的Fe2+生成Fe3+;加入氢氧化钠溶液后,调节溶液的pH至8,根据表中数据知,Fe3+、Al3+转化为沉淀除去;然后过滤,向滤液中加入钠离子交换树脂,然后加入二氧化硫,发生氧化还原反应得到Cr(OH)(H2O)5SO4。
(1)升高温度、搅拌、增大反应物浓度都可以提高浸取率,其采用措施为升高温度、搅拌、过滤后再向滤渣中加入硫酸(多次浸取)、适当延长浸取时间(只要答出任意一点即可,其他合理答案也可);
(2)过氧化氢具有氧化性,可将Fe2+和Cr3+氧化;
(3)pH=8时,Fe3+、Al3+完全生成沉淀,所以pH=8时除去阳离子为Fe3+、Al3+;
(4)钠离子交换树脂交换的离子是钙离子和镁离子,即:Mg2+、Ca2+;
(5)二氧化硫具有还原性,被滤液Ⅱ中通过离子交换后的溶液中Na2CrO4氧化为硫酸,Na2CrO4氧被还原为CrOH(H2O)5SO4,水溶液中生成硫酸反应生成硫酸钠,依据原子守恒分析书写配平;Na2CrO4+3SO2+11H2O=2CrOH(H2O)5SO4↓+Na2SO4,
根据方程式:3SO2~2CrOH(H2O)5SO4,可知每生成1mol Cr(OH)(H2O)5SO4转移电子的数目为3NA。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】实验室用CH3CH2OH分两步制备1,2-二溴乙烷现用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:
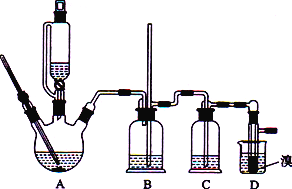
有关数据列表如下:
物质名称 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/(g·cm-3) | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)装置A中发生的化学方程式为_________________________________,反应类型为________,在此制备实验中,要尽可能迅速地把反应温度提高到170 ℃左右,其最主要目的是________(填字母)。
a 引发反应 b减少副产物乙醚生成 c 防止乙醇挥发 d加快反应速率
(2)在装置C中应加入________(填字母),其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3) 装置D中实验现象为_______________。
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在________(填“上”或“下”)层。
(5)反应过程中应用冷水冷却装置D,其主要目的是____________________________。