题目内容
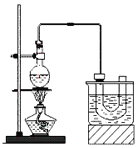
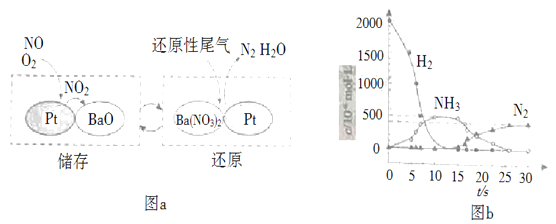
【题目】某学习小组拟利用下列装置探究CO2和锌粉反应是否生成CO,已知CO能与氯化钯溶液发生反应生成黑色金属钯:CO+PdCl2+H2O![]() CO2+Pd↓+2HCl。实验装置如图所示:
CO2+Pd↓+2HCl。实验装置如图所示:
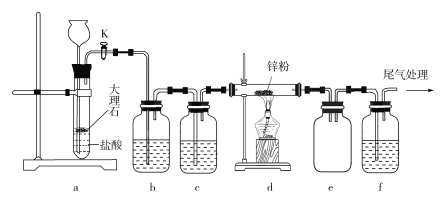
下列叙述正确的是
A. 实验开始时,先加热d处酒精灯,再打开活塞K
B. 装置b、c中分别装有饱和Na2CO3溶液和浓硫酸
C. 观察到装置f中溶液变黑,说明有CO气体生成
D. 装置e的作用是防倒吸,装置f导管口处点燃可以处理尾气
【答案】C
【解析】
A.实验开始时,应先打开活塞K,通入CO2将装置内空气排净,防止锌粉与空气反应,故A项错误;
B.制取的CO2中含有HCl和水蒸气,应先通过饱和NaHCO3溶液除去HCl,再通过浓硫酸干燥,故B项错误;
C.若f中溶液变黑色,说明生成钯,证明有CO生成,故C项正确;
D.尾气中含有CO和CO2,直接点燃可能导致爆炸或者无法点燃,采用点燃法处理尾气不合理,故D项错误,
故选C。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理。
某工厂对制革工业污泥中Cr元素的回收与再利用工艺如图(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):
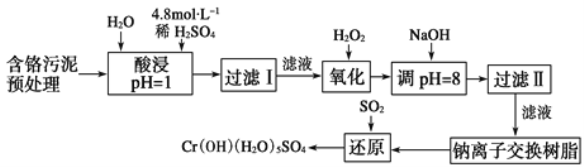
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | - | - | - |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 9(>9溶解) |
(1) 酸浸时,为了提高浸取率可采取的措施是____(至少写两条)。
(2)H2O2的作用是_____。
(3)调pH=8是为了除去___(填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(4)钠离子交换树脂的原理为Mn++nNaR→MRn+nNa+,被交换的杂质离子是___(填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(5)已知以下氧化还原反应方程式(未配平):Na2Cr2O7+SO2+H2O=Cr(OH)(H2O)5SO4+Na2SO4;以上反应各物质的配平系数依次为___。每生成1 mol Cr(OH)(H2O)5SO4转移电子的数目为___。
【题目】下表中评价合理的是( )
选项 | 化学反应及其离子方程式 | 评价 |
A | 铁与稀盐酸反应: | 正确 |
B | 大理石溶于醋酸的反应: | 错误,醋酸应写为分子形式CH3COOH,CaCO3应写成离子形式 |
C | 向Ba(OH)2溶液中滴加少量NaHCO3溶液:Ba2++ OH-+HCO3- = BaCO3↓+ H2O | 错误,方程式中Ba2+和OH-化学计量数之比为1∶2 |
D | NH4HCO3溶液与过量KOH浓溶液共热: | 错误,HCO3-也可以与OH-反应 |
A.AB.BC.CD.D