题目内容
【题目】下列离子方程式中书写正确的是( )
A.Na2CO3稀溶液中通入少量CO2:CO2+CO32-+H2O=2HCO![]()
B.向氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+
C.大理石溶于盐酸:CaCO3+2HCl=Ca2++CO2↑+H2O+2Cl-
D.铁粉投入稀硝酸:Fe+2H+=Fe2++H2↑
【答案】A
【解析】
A、少量二氧化碳气体通入碳酸钠溶液中生成碳酸氢钠,碳酸钠溶液中通入少量的CO2:CO2+CO32-+H2O=2HCO![]() ,故A正确;
,故A正确;
B、离子方程式要满足电荷守恒,故离子方程式为2Fe3++Fe═3Fe2+,故B错误;
C、HCl是强酸,可以拆,故离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O,故C错误;
D、铁片投入稀硝酸中,不能生成氢气,过量铁粉投入到稀硝酸中,离子方程式:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,故D错误。

【题目】利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理。
某工厂对制革工业污泥中Cr元素的回收与再利用工艺如图(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):
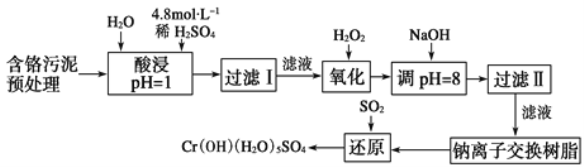
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | - | - | - |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 9(>9溶解) |
(1) 酸浸时,为了提高浸取率可采取的措施是____(至少写两条)。
(2)H2O2的作用是_____。
(3)调pH=8是为了除去___(填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(4)钠离子交换树脂的原理为Mn++nNaR→MRn+nNa+,被交换的杂质离子是___(填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(5)已知以下氧化还原反应方程式(未配平):Na2Cr2O7+SO2+H2O=Cr(OH)(H2O)5SO4+Na2SO4;以上反应各物质的配平系数依次为___。每生成1 mol Cr(OH)(H2O)5SO4转移电子的数目为___。