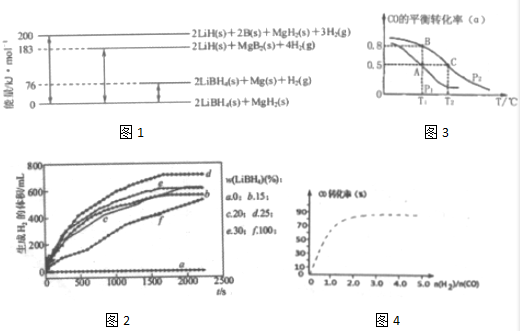
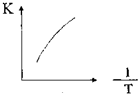
题目内容
17. Ⅰ.浓硝酸与浓盐酸混合过程中会产生少量的气体单质X、化合物M和无色液体,化合物M中所有原子均达到8电子的稳定结构.2molM加热分解生成lmol X和2mol无色气体Y,Y遇到空气呈现红棕色.
Ⅰ.浓硝酸与浓盐酸混合过程中会产生少量的气体单质X、化合物M和无色液体,化合物M中所有原子均达到8电子的稳定结构.2molM加热分解生成lmol X和2mol无色气体Y,Y遇到空气呈现红棕色.(1)镁与气体X反应产物的电子式为

(2)浓硝酸和浓盐酸反应的化学方程式为HNO3+3HCl=NOCl+Cl2+2H2O
(3)化合物M水解生成两种酸,为非氧化还原反应,该反应的化学方程式为NOCl+H2O=HNO2+HCl
Ⅱ.石油铁储罐久置未清洗易引发火灾,经分析研究,事故由罐体内壁附着的氧化物甲与溶于石油中的气态氢化物乙按1:3反应生成的黑色物质丙自燃引起.某研究小组将一定量的丙粉末投人足量的浓盐酸中发生反应,得到4.8g淡黄色沉淀和气体乙,乙在标准状况下的密度为1.52g•L-1,过滤后向滤液(假设乙全部逸出)中加人足量的NaOH溶液,先出现白色沉淀,最终转变为红褐色沉淀,过滤、洗涤、灼烧后的固体质量为24g.已知气体乙可溶于水.请回答下列问题:
(1)甲的化学式为Fe2O3.
(2)写出丙中非金属元素的离子结构示意图
 .
.(3)丙在盐酸中反应的化学方程式:Fe2S3+4H+=2H2S↑+2Fe2++S(离子方程式表示)
(4)请设计合理的实验方案验证不同温度对丙与盐酸反应速率的影响
(5)为消除火灾隐患,下列措施可行的是AD
A.石油入罐前脱硫 B.定期用酸清洗罐体 C.罐体内壁涂刷油漆 D.罐体中充入氮气.
分析 Ⅰ.Y遇到空气呈现红棕色,则Y为NO,浓硝酸与浓盐酸混合过程中会产生少量的气体单质X、化合物M和无色液体,则浓硝酸与浓盐酸发生氧化还原反应,化合物M中所有原子均达到8电子的稳定结构,2molM加热分解生成lmol X和2mol无色气体Y,根据元素守恒和电子得失守恒可推断,X为Cl2,M为NOCl,无色液体为水;
Ⅱ.丙粉末投人足量的浓盐酸中发生反应,得到4.8g淡黄色沉淀和气体乙,则淡黄色沉淀为S,物质的量为0.15mol,乙在标准状况下的密度为1.52g•L-1,则乙的相对分子质量为34,气体乙可溶于水,则乙为H2S,向滤液(假设乙全部逸出)中加人足量的NaOH溶液,先出现白色沉淀,最终转变为红褐色沉淀,则滤液中含有亚铁离子,灼烧后的固体为氧化铁,质量为24g,则铁元素的质量为16.8g,即为0.3mol,所以在丙中铁元素与硫单质的物质的量之比为2:1,而氧化物甲与气态氢化物乙按1:3反应生成的黑色物质丙,根据元素守恒和电子得失守恒可推断甲为Fe2O3,丙为Fe2S3,甲与乙发生的反应生成丙的反应为Fe2O3+3H2S=Fe2S3+3H2O,丙在盐酸中发生反应为Fe2S3+4HCl=2H2S↑+2FeCl2+S,符合题中条件,据此答题.
解答 解:Ⅰ.Y遇到空气呈现红棕色,则Y为NO,浓硝酸与浓盐酸混合过程中会产生少量的气体单质X、化合物M和无色液体,则浓硝酸与浓盐酸发生氧化还原反应,化合物M中所有原子均达到8电子的稳定结构,2molM加热分解生成lmol X和2mol无色气体Y,根据元素守恒和电子得失守恒可推断,X为Cl2,M为NOCl,无色液体为水,
(1)X为Cl2,镁与气体X反应产物为氯化镁,其的电子式为 ,故答案为:
,故答案为: ;
;
(2)浓硝酸和浓盐酸反应的化学方程式为HNO3+3HCl=NOCl+Cl2+2H2O,故答案为:HNO3+3HCl=NOCl+Cl2+2H2O;
(3)M为NOCl,M水解生成两种酸,为非氧化还原反应,根据化合价可知,应生成亚硝酸和盐酸,反应的化学方程式为NOCl+H2O=HNO2+HCl,
故答案为:NOCl+H2O=HNO2+HCl;
Ⅱ.丙粉末投人足量的浓盐酸中发生反应,得到4.8g淡黄色沉淀和气体乙,则淡黄色沉淀为S,物质的量为0.15mol,乙在标准状况下的密度为1.52g•L-1,则乙的相对分子质量为34,气体乙可溶于水,则乙为H2S,向滤液(假设乙全部逸出)中加人足量的NaOH溶液,先出现白色沉淀,最终转变为红褐色沉淀,则滤液中含有亚铁离子,灼烧后的固体为氧化铁,质量为24g,则铁元素的质量为16.8g,即为0.3mol,所以在丙中铁元素与硫单质的物质的量之比为2:1,而氧化物甲与气态氢化物乙按1:3反应生成的黑色物质丙,根据元素守恒和电子得失守恒可推断甲为Fe2O3,丙为Fe2S3,甲与乙发生的反应生成丙的反应为Fe2O3+3H2S=Fe2S3+3H2O,丙在盐酸中发生反应为Fe2S3+4HCl=2H2S↑+2FeCl2+S,符合题中条件,
(1)根据上面的分析可知,甲的化学式为Fe2O3,故答案为:Fe2O3;
(2)丙为Fe2S3,丙中非金属元素为硫元素,其离子结构示意图为  ,故答案为:
,故答案为: ;
;
(3)丙在盐酸中反应的离子方程式为Fe2S3+4H+=2H2S↑+2Fe2++S,故答案为:Fe2S3+4H+=2H2S↑+2Fe2++S;
(4)验证不同温度对丙与盐酸反应速率的影响,可以将盛有等浓度、等体积的盐酸的两个反应容器置于不同温度的水浴中,加入等量的Fe2S3,观察黑色物质消失的快慢,故答案为:将盛有等浓度、等体积的盐酸的两个反应容器置于不同温度的水浴中,加入等量的Fe2S3,观察黑色物质消失的快慢;
(5)要消除火灾隐患,即不能产生丙物质,也就是不能出现氧化铁和硫化氢,所以可以采取石油入罐前脱硫和罐体中充入氮气防止铁被氧化的方法,故选AD.
点评 本题考查了物质转化关系和物质性质的综合应用,主要考查了Fe、S、Cl、N的性质应用,题目难度较大,需要熟悉物质性质的特征反应,转化关系的分析判断.

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案| A. | 含碳元素的化合物都是有机物 | B. | 乙烯的结构简式是C2H4 | ||
| C. | 乙酸的酸性比碳酸弱 | D. | 蔗糖的分子式是C12H22O11 |
| 元素符号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径10-1nm | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | -2 | +2 | +1 | +5-3 | +7-1 | +1 | +5-3 | +3 |
| A. | 元素④的原子序数小于元素⑦的原子序数 | |
| B. | ②、③处于同一周期 | |
| C. | 上述八种元素中.最高价氧化物对应水化合物酸性最强的元素是⑤ | |
| D. | ⑧号元素原子结构示意图为: |
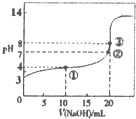 已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1CH3COOH溶液中逐滴加入0.1mol•L-1NaOH溶液变化),pH变化曲线如图所示(忽略温度),以下叙述正确的是( )
已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1CH3COOH溶液中逐滴加入0.1mol•L-1NaOH溶液变化),pH变化曲线如图所示(忽略温度),以下叙述正确的是( )| A. | 根据图中数据可计算出K值约为1×10-5 | |
| B. | ①②③点水的电离程度由大到小的顺序为:②>③>① | |
| C. | 点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 点③时c(CH3COOH)+(CH3COO-)=0.1mol/L |
| A. | 该溶液中,K+、Ca2+、Cl2、Br-可以大量共存 | |
| B. | 与FeCl3反应的离子方程式:SO32-+2 Fe3++H2O═SO42-+2Fe2++2H+ | |
| C. | 和足量Ca(OH)2溶液反应的离子方程式:Ca2++OH-+HSO3-═CaSO3↓+H2O | |
| D. | 能使含I2的淀粉溶液蓝色褪去,说明NaHSO3溶液具漂白性 |

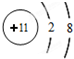 ;
;