题目内容
6.下列有关NaHSO3溶液的叙述正确的是( )| A. | 该溶液中,K+、Ca2+、Cl2、Br-可以大量共存 | |
| B. | 与FeCl3反应的离子方程式:SO32-+2 Fe3++H2O═SO42-+2Fe2++2H+ | |
| C. | 和足量Ca(OH)2溶液反应的离子方程式:Ca2++OH-+HSO3-═CaSO3↓+H2O | |
| D. | 能使含I2的淀粉溶液蓝色褪去,说明NaHSO3溶液具漂白性 |
分析 A.氯气具有强氧化性,能够氧化溴离子,亚硫酸氢根离子;
B.亚硫酸为二元弱酸,亚硫酸氢根离子在离子方程式中不能拆开;
C.氢氧化钙足量,则氢氧根离子过量,离子方程式按照亚硫酸氢钠的化学式书写;
D.碘单质能够将亚硫酸氢根离子氧化成硫酸根离子,亚硫酸氢钠表现了还原性,不是漂白性.
解答 解:A.Cl2、Br-之间发生氧化还原反应,Cl2也能够氧化NaHSO3,在溶液中不能大量共存,故A错误;
B.NaHSO3与FeCl3反应生成硫酸亚铁、和氯化氢,亚硫酸氢根离子不能拆开,正确的离子方程式为:HSO3-+2Fe3++H2O=SO42-+2Fe2++3H+,故B错误;
C.NaHSO3与足量Ca(OH)2溶液反应,氢氧根离子过量,反应的离子方程式为:Ca2++OH-+HSO3-=CaSO3↓+H2O,故C正确;
D.NaHSO3使含I2的淀粉溶液蓝色褪去,二者发生了氧化还原反应,说明NaHSO3溶液具有还原性,故D错误;
故选C.
点评 本题考查了离子共存的判断、离子方程式的书写,题目难度中等,注意掌握离子方程式的书写原则,明确离子共存的条件,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.下列离子方程式或化学方程式与所述事实相符且正确的是( )
| A. | 已知电离常数如表,则2NaF+H3PO4═2HF+Na2HPO4 | |
| B. | 以金属铜为电极电解饱和NaCl溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 向0.1mol?L-1、pH=1的NaHA溶液中加入NaOH溶液:H++OH-═H2O | |
| D. | 向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸:2OH-+CO32-+4H+═CO2↑+3H2O |
15.常温下,下列各组离子在给定溶液中一定能大量共存的是( )
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | Kw=1.01×10-14的某无色溶液:NH4+、K+、AlO2-、Cl- | |
| C. | 与铝反应产生大量氢气的溶液:Na+、Ba2+、HCO3-、NO3- | |
| D. | 由水电离出来的c(H+)=1.0×10-13 mol•L-1的溶液:K+、Na+、NO3-、Cl- |
 Ⅰ.浓硝酸与浓盐酸混合过程中会产生少量的气体单质X、化合物M和无色液体,化合物M中所有原子均达到8电子的稳定结构.2molM加热分解生成lmol X和2mol无色气体Y,Y遇到空气呈现红棕色.
Ⅰ.浓硝酸与浓盐酸混合过程中会产生少量的气体单质X、化合物M和无色液体,化合物M中所有原子均达到8电子的稳定结构.2molM加热分解生成lmol X和2mol无色气体Y,Y遇到空气呈现红棕色.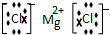
 .
. 铁单质及其化合物在生活、生产中有广泛应用.请回答下列问题:
铁单质及其化合物在生活、生产中有广泛应用.请回答下列问题: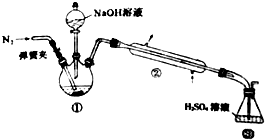 某小组以废铁屑、稀硫酸、饱和(NH4)2 SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X,为确定其组成,进行如下实验:
某小组以废铁屑、稀硫酸、饱和(NH4)2 SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X,为确定其组成,进行如下实验:
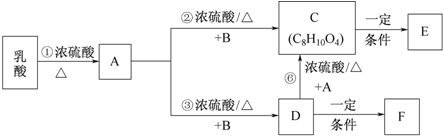
 .
. .
. .
. .
.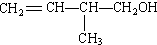
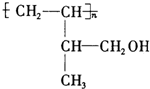 .
. .
.