题目内容
2.开发新能源、新材料是实现社会可持续发展的需要,请回答下列问题: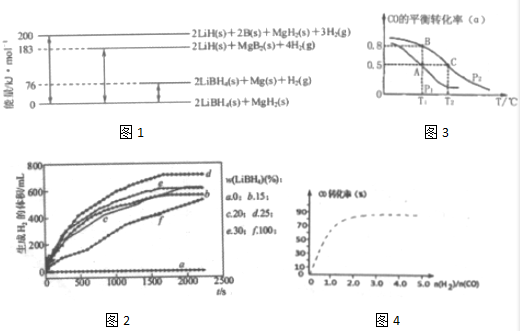
(1)如图1是2LiBH4/MgH2体系放氢焓变示意图.
则:Mg(s)+2B(s)=MgB2(s)△H═-93 kJ•mol-1.
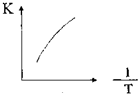
(2)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:25℃水浴时,每克不同配比的Al-LiBH,复合材料与水反应产生H2体积随时间变化关系如图2所示,下列说法正确的是AB.(填字母)
A、25℃时,纯铝与水不反应
B、25℃时,纯LiBH4与水反应产生氢气
C、25℃时,AI-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
(3)工业上可采用CO和H2合成再生能源甲醇,其反应的化学方程式为:CO(g)+2H2(g)═CH2OH(g).
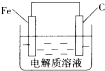
①在一容积可变的密闭容器中,充有10molCO和20molH2,用于合成甲醇.CO的平衡转化率(a)与温度(T).压强(P)的关系如图3所示:
上述合成甲醇的反应为放热反应(填“放热”或“吸热”),平衡常数KA、KB、KC的大小关系为KA=KB>KC.若达到平衡状态A时容器的体积为10L,则平衡状态B时容器的体积为2L.②图中虚线为该反应在使用催化剂条件下,起始H2,CO投料比和CO平衡转化率的关系图.当其他条件完全相同时,用实线画出不使用催化剂情况下,起始H2,CO投料比和CO平衡转化率的关系示意图4.
(4)已知参与电极反应的电极材料单位质量放出电能的大小称为该电池的比能量.关于二甲醚(CH3OCH3)碱性燃料电池与乙醇碱性燃料电池,下列说法正确的是C(填字母).
A、两种燃料互为同分异构体,分子式和摩尔质量相同,比能量相同
B、两种燃料所含共价键数目相同,断键时所需能量相同,比能量相同
C、两种燃料所含共价键类型不同,断键时所需能量不同,比能量不同
(5)LiFePO4与Li1-nFePO4作为磷酸亚铁锂电池电极材料,充放电过程中,发生LiFePO4与Li1-nFePO4之间的转化,电池放电时负极发生的反应为LinC1-xe-═xLi++6C,写出电池放电时反应的化学方程式Li1-xFePO4+LixC6=6C+LiFePO4.
分析 (1)由图可知:2LiBH4(s)+MgH2(s)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+200 kJ•mol-1①
2LiBH4(s)+MgH2(s)=2LiBH4(s)+Mg(s))+H2(g)△H=+76 kJ•mol-1②
2LiBH4(s)+MgH2(s)=2LiH(s)+MgB2(s)+4H2(g)△H=+183 kJ•mol-1③
2LiH(s)+MgB2(s)+4H2(g)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+(200-183)kJ•mol-1④
即:MgB2(s)+H2(g)=2B(s)+MgH2(s)△H=+17 kJ•mol-1④
所以-④-②得:Mg(s)+2B(s)═MgB2(s),据盖斯定律计算反应的焓变;
(2)①a.因为由图LiBH4含量为0时,氢气的体积为0,故25℃时,纯铝与水不反应,;
b.负一价的氢与正一价的氢发生归中反应生成氢气,LiBH4+4H2O=LiB(OH)4+4H2↑;
c.由图可知25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越小;
(3)根据温度和CO的转化率确定反应热;温度不变,化学平衡常数不变,温度升高平衡向吸热的方向移动,平衡常数变化;根据CO的转化率求出平衡常数,再根据A、B两点的平衡常数相同求出容器的体积;使用催化剂,加快反应速率,但是不会引起平衡的移动;
(4)根据乙醇和二甲醚中结构简式不同,发生反应时断裂的化学键不同,反应放出的能量不会相同,据此进行判断;
(5)根据磷酸亚铁锂电池充放电过程中,发生LiFePO4与Li1-xFePO4之间的转化及电池放电时负极发生的反应写出电池放电时反应的化学方程式.
解答 解:(1)由图可知:2LiBH4(s)+MgH2(s)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+200 kJ•mol-1①
2LiBH4(s)+MgH2(s)=2LiBH4(s)+Mg(s))+H2(g)△H=+76 kJ•mol-1②
2LiBH4(s)+MgH2(s)=2LiH(s)+MgB2(s)+4H2(g)△H=+183 kJ•mol-1③
2LiH(s)+MgB2(s)+4H2(g)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+(200-183)kJ•mol-1④
即:MgB2(s)+H2(g)=2B(s)+MgH2(s)△H=+17 kJ•mol-1④
所以-④-②得:Mg(s)+2B(s)═MgB2(s)△H=-(17+76)kJ•mol-1,
故答案为:-93 kJ•mol-1;
(2)①A、25℃时,纯铝与水不反应,因为由图LiBH4含量为0时,氢气的体积为0,故选;
B、25℃时,纯LiBH4与水反应产生氢气,负一价的氢与正一价的氢发生归中反应生成氢气,故选;
C、由图可知25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越小,故不选;
故答案为:AB;
(3)据图象可知,温度升高平衡逆向移动,即逆反应方向为吸热,所以正反应方向为放热;因B点与A点温度相同,K不变,对于上述反应温度升高平衡向逆反应方向移动,平衡常数减小,所以A、B、C三点的平衡常数KA=KB>KC,T1时,A点对应的α=0.5,据平衡常数表达式可得K=1.因B点与A点温度相同,K不变,
CO(g)+2H2(g)?CH3OH(g).
起始(mol) 10 20 0
转化(mol) 8 16 8
平衡(mol) 2 4 8
则K=$\frac{\frac{8}{V}}{\frac{2}{V}×(\frac{4}{V})^{2}}$=1,解得:V=2L,使用催化剂,加快反应速率,但是不会引起平衡的移动,当不使用催化剂,起始H2,CO投料比和CO平衡转化率的关系示意图如下: ,故答案为:放热;KA=KB>KC;2;
,故答案为:放热;KA=KB>KC;2; ;
;
(4)化学反应实质是旧键的断裂和新键的生成,放出的能量与旧键断裂吸收的能量和新键的生成放出的能量有关,而二甲醚和乙醇分子中化学键类型不同,所以反应过程中放出的能量不同,所以C正确,
故答案为:C;
(5)磷酸亚铁锂电池充放电过程中,发生LiFePO4与Li1-xFePO4之间的转化,其中LiFePO4→Li1-xFePO4的转化化合价降低,发生还原反应,而电池放电时负极发生的反应为:LixC6-xe-═xLi++6C,该反应为氧化反应,所以反应转化应该为:LiFePO4→Li1-xFePO4,所以电池放电时反应的化学方程式为:Li1-xFePO4+LixC6=6C+LiFePO4,
故答案为:Li1-xFePO4+LixC6=6C+LiFePO4.
点评 本题考查了热化学方程式书写、原电池、电解池工作原理、化学反应速率和平衡的影响因素及有关计算等知识,注意把握题中信息,能够正确提取题中信息,联系所学知识进行解答,试题充分培养了学生的分析、理解能力及灵活应用所学知识的能力本题涉及热化学方程式的书写,盖斯定律的应用,电化学知识,综合性非常强,难度大.

 名校课堂系列答案
名校课堂系列答案| A. | lH、2H、3H为同素异形体 | B. | lH、2H、3H互为同位素 | ||
| C. | lH、2H、3H的质量数相同 | D. | lH、2H、3H为同分异构体 |
| A. | CuSO4 | B. | Fe2(SO4)3 | C. | 稀HNO3 | D. | Al2(SO4)3 |
| A. | 氯化铁溶液、溴水 | B. | 碳酸钠溶液、溴水 | ||
| C. | KMnO4酸性溶液、溴水 | D. | KMnO4酸性溶液、氯化铁溶液 |
| A. | c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32- | |
| B. | 溶液中含大量Al3+:HClO、HCO3-、ClO-、CO32- | |
| C. | 能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I- | |
| D. | 中性的溶液中:CO32-、Na+、SO42-、AlO2- |
| A. | 乙醇与金属钠的反应 | |
| B. | 苯与浓硝酸、浓硫酸混合共热制取硝基苯 | |
| C. | 在催化剂存在条件下,乙烯与氯化氢反应制氯乙烷 | |
| D. | 实验室制乙炔 |
 Ⅰ.浓硝酸与浓盐酸混合过程中会产生少量的气体单质X、化合物M和无色液体,化合物M中所有原子均达到8电子的稳定结构.2molM加热分解生成lmol X和2mol无色气体Y,Y遇到空气呈现红棕色.
Ⅰ.浓硝酸与浓盐酸混合过程中会产生少量的气体单质X、化合物M和无色液体,化合物M中所有原子均达到8电子的稳定结构.2molM加热分解生成lmol X和2mol无色气体Y,Y遇到空气呈现红棕色.
 .
. 铁单质及其化合物在生活、生产中有广泛应用.请回答下列问题:
铁单质及其化合物在生活、生产中有广泛应用.请回答下列问题: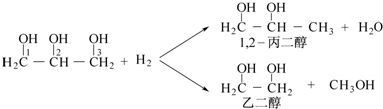
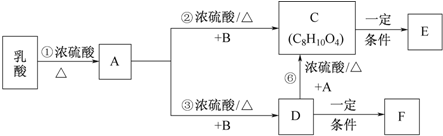
 .
. .
.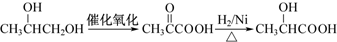 .
. .
.