题目内容
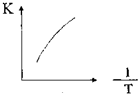
12.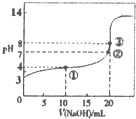 已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1CH3COOH溶液中逐滴加入0.1mol•L-1NaOH溶液变化),pH变化曲线如图所示(忽略温度),以下叙述正确的是( )
已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1CH3COOH溶液中逐滴加入0.1mol•L-1NaOH溶液变化),pH变化曲线如图所示(忽略温度),以下叙述正确的是( )| A. | 根据图中数据可计算出K值约为1×10-5 | |
| B. | ①②③点水的电离程度由大到小的顺序为:②>③>① | |
| C. | 点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 点③时c(CH3COOH)+(CH3COO-)=0.1mol/L |
分析 A.起点pH=3,根据CH3COOH?CH3COO-+H+和醋酸的电离平衡常数表达式进行计算;
B.酸或碱抑制水电离,含有弱离子的盐促进水电离;
C.点①是加入10ml氢氧化钠溶液和醋酸反应,得到溶液中是等浓度的醋酸和醋酸钠溶液,结合溶液中电荷守恒和物料守恒计算分析;
D.点③是加入20ml氢氧化钠溶液和醋酸反应,得到溶液中是醋酸钠溶液,结合溶液中物料守恒计算分析.
解答 解:A.起点pH=3,由CH3COOH?CH3COO-+H+可知,c(H+)=c(CH3COO-)=10-3mol/L,该温度下醋酸的电离平衡常数K=$\frac{1{0}^{-3}×1{0}^{-3}}{0.1}$=1×10-5,故A正确;
B.酸或碱抑制水电离,①点溶液中含有酸,所以抑制水电离,②点呈中性,但溶质为醋酸钠和醋酸,醋酸电离程度等于醋酸根离子水解程度,水自然电离,③点溶质为醋酸钠,醋酸根离子水解促进水电离,所以①②③点水的电离程度由大到小的顺序为:③>②>①,故B错误;
C.点①是加入10ml氢氧化钠溶液和醋酸反应,得到溶液中是等浓度的醋酸和醋酸钠溶液,溶液呈酸性,则c(H+)>c(OH-),醋酸的电离大于醋酸钠的水解,则c(CH3COO-)>(CH3COOH),结合溶液中电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+)①,溶液中存在物料守恒:2c(Na+)=c(CH3COO-)+c(CH3COOH)②,①×2+②得到:c(CH3COO-)+2c(OH-)=(CH3COOH)+2c(H+),则溶液中c(CH3COO-)+c(OH-)>(CH3COOH)+c(H+),故C错误;
D.点③是加入20ml氢氧化钠溶液和醋酸反应,得到溶液中是醋酸钠溶液,结合溶液中存在物料守恒:c(Na+)=c(CH3COO-)+c(CH3COOH)=0.05mol/L,故D错误;
故选A.
点评 本题考查酸碱混合溶液的定性判断,明确图象中各点的pH及溶液中的溶质即可解答,注意电荷守恒、物料守恒及电离平衡常数,题目难度不大.

 一本好题口算题卡系列答案
一本好题口算题卡系列答案| A. | 葡萄糖能水解成乙醇和二氧化碳 | |
| B. | 氨基乙酸、甲醛、乙二醇均可发生聚合反应 | |
| C. | 苯酚能跟碳酸钠溶液反应,则苯酚的酸性比碳酸强 | |
| D. | 实验室用溴乙烷在浓硫酸存在并加热条件下制备乙烯 |
| A. | 1L1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 标准状况下,2.24L CHCl3的分子数为0.1NA | |
| C. | 1L0.1mol•L-1的氨水中有0.1NA个N原子 | |
| D. | 标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA |
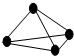 原子间以共价单键相连的非金属单质中,一个原子与相邻原子的成键数为8-N,N为该非金属元素的族序数,化学家把这一现象称为8-N规则.某非金属单质的结构如图所示,则构成该单质的元素位于( )
原子间以共价单键相连的非金属单质中,一个原子与相邻原子的成键数为8-N,N为该非金属元素的族序数,化学家把这一现象称为8-N规则.某非金属单质的结构如图所示,则构成该单质的元素位于( )| A. | ⅢA | B. | ⅣA | C. | ⅤA | D. | ⅥA |
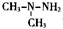 是运载火箭的主体燃料.C2H8N2物质中含碳碳单键的同分异构体共有( )
是运载火箭的主体燃料.C2H8N2物质中含碳碳单键的同分异构体共有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
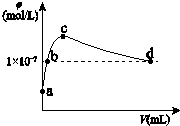 常温下,向1L pH=10的 NaOH溶液中持续通入CO2.通入的CO2的体积(V)与溶液中水电离出的OH-离子浓度(φ)的关系如图所示.下列叙述不正确的是( )
常温下,向1L pH=10的 NaOH溶液中持续通入CO2.通入的CO2的体积(V)与溶液中水电离出的OH-离子浓度(φ)的关系如图所示.下列叙述不正确的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-10mol/L | |
| B. | b点溶液中:c(H+)=1×10-7mol/L | |
| C. | c点溶液中:c(Na+)>c(CO32-)>c(HCO3-) | |
| D. | d点溶液中:c(Na+)=2c(CO32-)+c(HCO3-) |
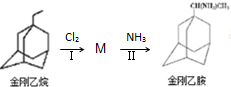
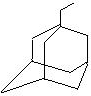 ,如金刚乙烷表示为R-CH2CH3);
,如金刚乙烷表示为R-CH2CH3);
 .
. .
. Ⅰ.浓硝酸与浓盐酸混合过程中会产生少量的气体单质X、化合物M和无色液体,化合物M中所有原子均达到8电子的稳定结构.2molM加热分解生成lmol X和2mol无色气体Y,Y遇到空气呈现红棕色.
Ⅰ.浓硝酸与浓盐酸混合过程中会产生少量的气体单质X、化合物M和无色液体,化合物M中所有原子均达到8电子的稳定结构.2molM加热分解生成lmol X和2mol无色气体Y,Y遇到空气呈现红棕色.
 .
.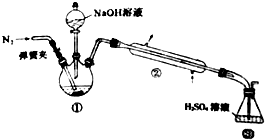 某小组以废铁屑、稀硫酸、饱和(NH4)2 SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X,为确定其组成,进行如下实验:
某小组以废铁屑、稀硫酸、饱和(NH4)2 SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X,为确定其组成,进行如下实验: