题目内容
7.X和Y属短周期元素,X原子的最外层电子数是次外层电子数的3倍,Y位于X的前一周期,且最外层只有一个电子,则X和Y形成的化合物的化学式可表示为( )| A. | XY | B. | Y2X | C. | Y3X | D. | YX |
分析 X原子的最外层电子数是次外层电子数的3倍,原子核外应有2个电子层,X为O元素,Y位于X的前一周期,且最外层只有一个电子,Y为H元素,以此解答该题.
解答 解:X原子的最外层电子数是次外层电子数的3倍,原子核外应有2个电子层,最外层电子数为6,X为O元素,Y位于X的前一周期,且最外层只有一个电子,Y为H元素,则X和Y形成的化合物的化学式可表示为Y2X或Y2X2,只有B符合.
故选B.
点评 本题考查原子结构和元素性质,为高频考点,侧重考查学生发散思维能力,明确O元素常见化合物及其化学式是解本题关键,题目难度不大.

练习册系列答案
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
15.常温下,下列各组离子在给定溶液中一定能大量共存的是( )
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | Kw=1.01×10-14的某无色溶液:NH4+、K+、AlO2-、Cl- | |
| C. | 与铝反应产生大量氢气的溶液:Na+、Ba2+、HCO3-、NO3- | |
| D. | 由水电离出来的c(H+)=1.0×10-13 mol•L-1的溶液:K+、Na+、NO3-、Cl- |
2.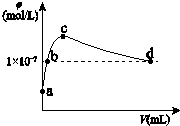 常温下,向1L pH=10的 NaOH溶液中持续通入CO2.通入的CO2的体积(V)与溶液中水电离出的OH-离子浓度(φ)的关系如图所示.下列叙述不正确的是( )
常温下,向1L pH=10的 NaOH溶液中持续通入CO2.通入的CO2的体积(V)与溶液中水电离出的OH-离子浓度(φ)的关系如图所示.下列叙述不正确的是( )
 常温下,向1L pH=10的 NaOH溶液中持续通入CO2.通入的CO2的体积(V)与溶液中水电离出的OH-离子浓度(φ)的关系如图所示.下列叙述不正确的是( )
常温下,向1L pH=10的 NaOH溶液中持续通入CO2.通入的CO2的体积(V)与溶液中水电离出的OH-离子浓度(φ)的关系如图所示.下列叙述不正确的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-10mol/L | |
| B. | b点溶液中:c(H+)=1×10-7mol/L | |
| C. | c点溶液中:c(Na+)>c(CO32-)>c(HCO3-) | |
| D. | d点溶液中:c(Na+)=2c(CO32-)+c(HCO3-) |
12.下列反应中,不属于取代反应的是( )
| A. | 乙醇与金属钠的反应 | |
| B. | 苯与浓硝酸、浓硫酸混合共热制取硝基苯 | |
| C. | 在催化剂存在条件下,乙烯与氯化氢反应制氯乙烷 | |
| D. | 实验室制乙炔 |
17. 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 非金属性:Z<T<X | B. | R与Q的电子数相差26 | ||
| C. | 气态氢化物稳定性:R<T<Q | D. | 最高价氧化物的水化物的酸性:R>T |
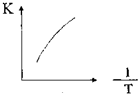 Ⅰ.浓硝酸与浓盐酸混合过程中会产生少量的气体单质X、化合物M和无色液体,化合物M中所有原子均达到8电子的稳定结构.2molM加热分解生成lmol X和2mol无色气体Y,Y遇到空气呈现红棕色.
Ⅰ.浓硝酸与浓盐酸混合过程中会产生少量的气体单质X、化合物M和无色液体,化合物M中所有原子均达到8电子的稳定结构.2molM加热分解生成lmol X和2mol无色气体Y,Y遇到空气呈现红棕色.
 .
.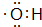 ;
; 的系统命名为3-甲基戊烷.
的系统命名为3-甲基戊烷. .
.
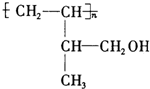 .
.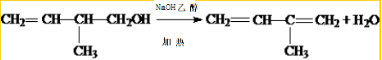 .
.