题目内容
5.根据下列几种粒子的结构示意图,回答问题:
(1)其中属于阴离子的是B(填代号)其离子符号为O2-;
(2)属于金属元素的是D(填代号),相对应的离子结构示意图为
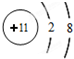 ;
;(3)具有相似化学性质的是AC(填代号,下同),在化学反应中易失去电子的是D,性质最稳定的是E;
(4)C、D经过得失电子后,所形成化合物的化学式为Na2S;
(5)在核电荷数为1~18的元素中,列举四例与B电子层结构相同的离子,写出离子的符号
F-、Na+、Mg2+、Al3+.
分析 (1)阴离子:质子数小于核外电子数,依此进行判断;
(2)金属元素:最外层电子数一般小于4,依此进行判断;
(3)化学性质:由最外层电子数决定,最外层电子数相同,化学性质相似;最外层电子数小于4,在化学反应中易失去电子生成阳离子;最外层电子数为8,性质最稳定,依此进行判断;
(4)C为硫原子,得到电子,生成硫离子;D是钠原子,失去电子生成钠离子,两者结合生成硫化钠;
(5)最外层有10个电子的离子有氧离子、氟离子、钠离子、镁离子、铝离子等.
解答 解:(1)阴离子:质子数小于核外电子数,故属于阴离子的是B,离子符号为O2-,
故答案为:B;O2-,
(2)金属元素:最外层电子数一般小于4,故属于金属元素的是D,D失去1个电子生成对应的离子,该离子的结构示意图为: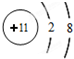 ,
,
故答案为:D;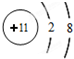 ;
;
(3)化学性质:由最外层电子数决定,最外层电子数相同,化学性质相似,故具有相似化学性质的是AC;
最外层电子数小于4,在化学反应中易失去电子生成阳离子,故在化学反应中易失去电子的是D;
最外层电子数为8,性质最稳定,故性质最稳定的是E;
故答案为:AC;D;E;
(4)C为硫原子,得到电子,生成硫离子;D是钠原子,失去电子生成钠离子,硫离子与钠离子形成的化合物的化学式为Na2S,
故答案为:Na2S;
(5)最外层有10个电子的离子有氧离子、氟离子、钠离子、镁离子、铝离子等,符号为O2-、F-、Na+、Mg2+、Al3+(任意4个就可),
故答案为:F-、Na+、Mg2+、Al3+.
点评 本题考查学生对粒子结构示意图及其意义的理解,难度不大.粒子结构示意图的含义是正确解答此类题的关键.

练习册系列答案
相关题目
1.下列实验“操作和现象”与“结论”对应关系正确的是( )
| 选项 | 操作和现象 | 结论 |
| A | CH4和Cl2混合于试管中光照,颜色逐渐褪去 | 二者发生了化合反应 |
| B | 微热滴有2滴酚酞的饱和NaHCO3溶液,溶液颜色加深 | NaHCO3受热分解生成了Na2CO3 |
| C | 向淀粉溶液中加入20%的硫酸,加热几分钟,冷却后再加入银氨溶液,水浴,没有银镜生成 | 淀粉没发生水解 |
| D | 向装有Fe(NO3)2溶液的试管中加入稀硫酸,观察到试管口有红棕色气体产生 | 酸性环境下,NO3-被Fe2+还原为NO,NO遇氧气生成NO2 |
| A. | A | B. | B | C. | C | D. | D |
2.下列离子方程式或化学方程式与所述事实相符且正确的是( )
| A. | 已知电离常数如表,则2NaF+H3PO4═2HF+Na2HPO4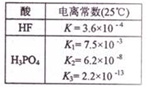 | |
| B. | 以金属铜为电极电解饱和NaCl溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 向0.1mol?L-1、pH=1的NaHA溶液中加入NaOH溶液:H++OH-═H2O | |
| D. | 向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸:2OH-+CO32-+4H+═CO2↑+3H2O |
19.将铁片分别加入下列溶液中,铁片能溶解且溶液质量减轻的是( )
| A. | CuSO4 | B. | Fe2(SO4)3 | C. | 稀HNO3 | D. | Al2(SO4)3 |
10.可用来鉴别己烯、苯酚、甲苯、乙酸乙酯溶液的一组试剂是( )
| A. | 氯化铁溶液、溴水 | B. | 碳酸钠溶液、溴水 | ||
| C. | KMnO4酸性溶液、溴水 | D. | KMnO4酸性溶液、氯化铁溶液 |
15.常温下,下列各组离子在给定溶液中一定能大量共存的是( )
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | Kw=1.01×10-14的某无色溶液:NH4+、K+、AlO2-、Cl- | |
| C. | 与铝反应产生大量氢气的溶液:Na+、Ba2+、HCO3-、NO3- | |
| D. | 由水电离出来的c(H+)=1.0×10-13 mol•L-1的溶液:K+、Na+、NO3-、Cl- |
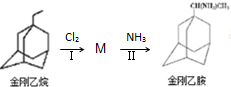
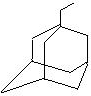 ,如金刚乙烷表示为R-CH2CH3);
,如金刚乙烷表示为R-CH2CH3);
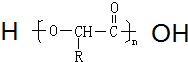 .
.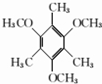 .
. Ⅰ.浓硝酸与浓盐酸混合过程中会产生少量的气体单质X、化合物M和无色液体,化合物M中所有原子均达到8电子的稳定结构.2molM加热分解生成lmol X和2mol无色气体Y,Y遇到空气呈现红棕色.
Ⅰ.浓硝酸与浓盐酸混合过程中会产生少量的气体单质X、化合物M和无色液体,化合物M中所有原子均达到8电子的稳定结构.2molM加热分解生成lmol X和2mol无色气体Y,Y遇到空气呈现红棕色.
 .
.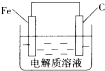 铁单质及其化合物在生活、生产中有广泛应用.请回答下列问题:
铁单质及其化合物在生活、生产中有广泛应用.请回答下列问题: