题目内容
10. 已知A、B、C、D、E五种元素的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2对成对电子.请回答下列问题:
已知A、B、C、D、E五种元素的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2对成对电子.请回答下列问题:(1)E元素基态原子的电子排布式为1s22s22p63s23p1.
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为C、O、N(填元素符号).
(3)D元素与氟元素相比,电负性:D<F(填“>”、“=”或“<”).
(4)元素A、B、C可以形成原子个数比为1:1:1的化合物,请写出该化合物的电子式:
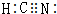
(5)B、C、D与A所形成的简单的化合物中,熔点从高到低的顺序是:H2O>NH3>CH4
(用化学式表示),原因是:水分子与氨分子间存在氢键,且水分子氢键强于氨分子氢键,故水熔点高于氨分子;而甲烷只存在分子间的范德华力,分子间氢键大于范德华力
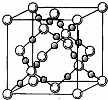
(6)BD2在高温高压下所形成的晶体其晶胞如图所示.该晶体的类型属于分子(选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子轨道的杂化类型为sp3.l molB2A2分子中含键的数目是3NA(或1.806×1024).
(7)光谱证实单质E与强碱溶液反应有[E(OH)4]-生成,则[E(OH)4]-中存在abc.
a.共价键 b.配位键 c.σ键 d.π键.
分析 A、B、C、D、E五种元素的原子序数依次增大,B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍,则B原子核外有6个电子,则B为C元素;D原子L层上有2对成对电子,则D原子电子排布式为1s22s22p4,所以D为O元素;原子序数A<B,B为碳元素,A原子的最外层电子数等于其周期序数,则A为H元素;E原子的最外层电子数等于其周期序数,E原子的电子层数是A的3倍,E为Al元素,据此进行解答.
解答 解:A、B、C、D、E五种元素的原子序数依次增大,B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍,则B原子核外有6个电子,则B为碳元素;D原子L层上有2对成对电子,则D原子电子排布式为1s22s22p4,所以D为氧元素;C原子序数介于碳元素与氧元素之间,则C为氮元素;原子序数A<B,B为碳元素,A原子的最外层电子数等于其周期序数,则A为氢元素;E原子的最外层电子数等于其周期序数,E原子的电子层数是A的3倍,E为铝元素,根据分析可知:A为氢元素、B为碳元素、C为氮元素、D为氧元素、E为铝元素,
(1)E为铝元素,原子核外有13个电子,基态原子的电子排布式为:1s22s22p63s23p1,
故答案为:1s22s22p6 3s23p1;
(2)B为碳元素;C为氮元素;D为氧元素,同周期第一电离能自左而右具有增大趋势,所以第一电离能O>C,由于氮元素原子2p能级有3个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素,所以B、C、D三种元素的第一电离能数值由小到大的顺序为:C、O、N,
故答案为:C、O、N;
(3)D为氧元素,同周期自左而右电负性增大,所以电负性:O<F,
故答案为:<;
(4)元素A、B、C可以形成原子个数比为1:1:1的化合物为HCN,HCN中含有碳氮三键,且N原子含有1对孤电子对,HCN的电子式为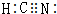 ,
,
故答案为: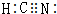 ;
;
(5)B、C、D与A所形成的简单的化合物分别为:CH4、NH3、H2O,由于水分子与氨分子间存在氢键,且水分子氢键强于氨分子氢键,故水熔点高于氨分子;而甲烷只存在分子间的范德华力,分子间氢键大于范德华力,所以三者的沸点大小为:H2O>NH3>CH4,
故答案为:H2O>NH3>CH4;水分子与氨分子间存在氢键,且水分子氢键强于氨分子氢键,故水熔点高于氨分子;而甲烷只存在分子间的范德华力,分子间氢键大于范德华力;
(6)BD2是CO2,由晶体结构图可知,大球为碳原子,小球为氧原子,每个碳原子周围有4个氧原子,每个氧原子周围有2个碳原子,晶体中不存在CO2分子,故在高温高压下所形成的晶体为原子晶体,该晶体中C原子轨道的杂化数为4,碳原子采取sp3杂化;B2A2为C2H2,C2H2的结构式为H-C≡CH,单键为δ键,三键含有1个δ键、2个π键,1个C2H2分子中含有3个δ键,所以l molC2H2分子中含σ键的数目是3 NA(或1.806×1024).
故答案为:原子;sp3;3NA(或1.806×1024);
(7)E为铝元素,光谱证实单质E与强碱溶液反应有[Al(OH)4]-生成,[Al(OH)4]-中氧原子与氢原子之间为共价键,是单键,属于δ键,铝离子与氢氧根离子之间形成配位键,配位键也属于共价键.所以,[Al(OH)4]-中存在共价键、配位键、δ键.
故选:abc.
点评 本题考查位置、结构与性质关系的综合应用,题目难度中等,涉及原子结构、电负性、电离能、化学键与晶体结构等知识,是对所学知识的综合考查与运用,根据结构推断元素是解题关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系.

| A. | 一定含甲烷 | B. | 一定有乙烷 | ||
| C. | 一定是甲烷和乙烯的混合气体 | D. | 一定是甲烷和丙炔的混合气体 |
| A. | 6种 | B. | 4种 | C. | 3种 | D. | 2种 |
| A. | CH3CH2CHO | B. | OHCCH(OH)CH2OH | ||
| C. | 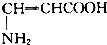 | D. | 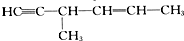 |
| A. | 等量的硫蒸气和硫固体分别完全燃烧,前者反应速率快,后者放出热量多 | |
| B. | 由C(石墨)→C(金刚石)△H=+1.9 kJ•mol-1可知,石墨比金刚石稳定 | |
| C. | 在稀溶液中:H++OH-═H2O△H1=-57.3 kJ•mol-1,若含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液的反应热为△H2,则△H1>△H2 | |
| D. | 在101 kPa时,10g H2完全燃烧生成液态水,放出1429 kJ热量,氢气燃烧热的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=-517.6 kJ•mol-1 |
 ),则Q=154.
),则Q=154.