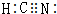题目内容
19.如图示意图是实验室中常用于制取气体的装置,根据你所掌握的知识回答下列问题:
(1)制取下列气体的装置分别是(填字母代号):氯气C、氨气B、二氧化碳A、NOA
(2)以上气体可以用E装置收集的有(填化学式)Cl2或NO
(3)分别写出实验室制取Cl2和NH3的化学方程式:Cl2:MnO2+4HCl (浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;NH3:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
分析 (1)依据反应物状态与反应条件选择发生装置;
(2)E为排液法收集气体,气体不能与液体反应,且在液体溶解度较小;
(3)实验室制备氨气是利用氢氧化钙和氯化铵固体加热反应生成;
实验室利用浓盐酸与二氧化锰制取Cl2,据此书写化学方程式即可.
解答 解:(1)氯气:固体二氧化锰与浓盐酸加热,应选择C装置;氨气:固体氯化铵、氢氧化钙加热,应选择装置B;二氧化碳:固体碳酸钙与稀盐酸不加热,应选择装置A;NO:固体铜与稀硝酸反应不加热,应选择装置A;
故答案为:C;B; A; A;
(2)E为排液法收集气体,气体不能与液体反应,且在液体溶解度较小,氯气在饱和食盐水中溶解度较小,可以用排饱和食盐水的方法收集氯气;
一氧化氮不溶于水,可以用排水法收集;
故答案为:Cl2或NO;
(3)实验室制备氨气是利用氢氧化钙和氯化铵固体加热反应生成,反应的化学方程式为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑,
实验室利用浓盐酸与二氧化锰制取Cl2,化学方程式为:MnO2+4HCl (浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;MnO2+4HCl (浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
点评 本题考查了气体的制备和装置的选择,题目难度不大,注意依据反应物状态和反应条件选择发生装置,依据气体的性质选择收集装置.

练习册系列答案
相关题目
9.一定温度下,向一个容器为2L的真空密闭容器中通入2molN2和6molH2,3min后,测得容器内的压强是开始时的0.7倍,则这段时间内v(H2)为( )
| A. | 0.2mol•L-1•min-1 | B. | 0.6mol•L-1•min-1 | ||
| C. | 1.8mol•L-1•min-1 | D. | 3.6mol•L-1•min-1 |
7.能与NaOH溶液反应放出气体,向反应后的溶液里通入足量CO2时能得到沉淀的是( )
| A. | Mg | B. | Al | C. | Si | D. | Cl2 |
14.用等量的小苏打制取CO2,可用①煅烧法、②与酸作用,两种方法得到CO2的量哪个多( )
| A. | 无法比较 | B. | 相等 | C. | ①少于② | D. | ①多于② |
4.根据你的实验观察和记录,下面关于Na2CO3和NaHCO3性质的叙述,正确的是( )
| A. | 受热时Na2CO3比NaHCO3稳定 | |
| B. | 同温同压下,在水中Na2CO3比NaHCO3溶解性小 | |
| C. | 物质的量相等的Na2CO3和NaHCO3分别溶于等体积的水后,Na2CO3水溶液的碱性较弱 | |
| D. | 质量相等的Na2CO3和NaHCO3分别与足量盐酸反应,Na2CO3放出的CO2少 |
11.下列关于元素周期表的说法不正确的是( )
| A. | 元素周期表中一共有16个纵行 | |
| B. | 除零族元素外,非金属元素全都是主族元素 | |
| C. | 同周期ⅡA族与ⅢA族元素的原子序数之差可能为25 | |
| D. | 同族上下相邻两种元素的原子序数之差可能为32 |
8.某有机物的结构简式如图,下列关于该有机物的叙述不正确的是( )
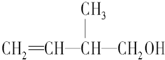

| A. | 能与金属钠反应并放出氢气 | |
| B. | 能在催化剂作用下与H2发生加成反应 | |
| C. | 能发生银镜反应 | |
| D. | 在浓H2SO4催化下能与乙酸发生酯化反应 |
9.能正确表示下列反应的离子方程式是( )
| A. | 铁跟盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 磷酸二氢钙溶液跟氢氧化钙溶液反应 H2PO4-+2OH-═PO43-+2H2O | |
| C. | 碳酸钙跟醋酸反应:CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ | |
| D. | 铜片跟稀硝酸反应 Cu+NO3-+4H+═Cu2++NO↑+2H2O |
 已知A、B、C、D、E五种元素的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2对成对电子.请回答下列问题:
已知A、B、C、D、E五种元素的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2对成对电子.请回答下列问题: