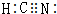题目内容
18.A、B、C、D四种短周期元素,原子序数依次增大;A和C能形成一种+1价阳离子Y;B元素的原子最外层电子数是次外层电子数的2倍;C、D在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体.试回答下列问题:(1)D的元素名称为氧.元素B位于周期表中第二周期IVA族.
(2)写出一种由A、B、C、D四种元素组成的常见无机化合物的化学式NH4HCO3或(NH4)2CO3,其中所含的化学键类型为离子键、共价键.
(3)写出Y水解的离子方程式NH4++H2O?NH3•H2O+H+.
(4)在25℃,101kPa时,1g A单质在O2中充分燃烧,放出143kJ的热量.则表示A单质燃烧热的热化学方程式为H2(g)+1/2O2(g)=H2O(l);△H=-286kJ/mol.
分析 A、B、C、D四种短周期元素,原子序数依次增大;B元素的原子最外层电子数是次外层电子数的2倍,最外层电子数不超过8个,则B元素的次外层是第一电子层,则B是C元素;C、D在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,且C的原子序数小于D,则C是N元素,D是O元素,A和C能形成一种+1价阳离子Y,则A是H元素,Y是NH4+,结合物质的性质来分析解答
解答 解:A、B、C、D四种短周期元素,原子序数依次增大;B元素的原子最外层电子数是次外层电子数的2倍最外层电子数不超过8个,则B元素的次外层是第一电子层,则B是C元素,C、D在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,且C的原子序数小于D,则C是N元素,D是O元素,A和C能形成一种+1价阳离子Y,则A是H元素,Y是NH4+,
(1)根据上面的分析可知,D是氧元素,B是C元素,C原子核外有6个电子,有2个电子层,最外层有4个电子,主族元素的电子层数等于其周期数,最外层电子数等于其族序数,所以B在周期表中的位置为第二周期第IVA族,
故答案为:氧;二;IVA;
(2)由H、C、N、O四种元素组成的常见化合物的化学式 NH4HCO3或(NH4)2CO3,铵根离子和碳酸氢根离子或碳酸根离子间都存在离子键,氮原子和氢原子之间都存在共价键,碳原子和氧原子之间存在共价键,其中所含的化学键类型为离子键和共价键,
故答案为:NH4HCO3或(NH4)2CO3;离子键、共价键;
(3)Y是铵根离子,铵根离子水解生成一水合氨和氢离子,铵根水解离子方程式为NH4++H2O?NH3•H2O+H+,
故答案为:NH4++H2O?NH3•H2O+H+;
(4)A是H元素,在25℃,101kPa时,1g A单质在O2中充分燃烧,放出143kJ的热量,所以1mol氢气燃烧放出286kJ的热量,则表示氢气燃烧热的热化学方程式为H2(g)+1/2O2(g)=H2O(l);△H=-286kJ/mol,
故答案为:H2(g)+1/2O2(g)=H2O(l);△H=-286kJ/mol.
点评 本题考查了热化学反应方程式的书写、水解反应方程式的书写、化学键的判断等知识点,正确推断元素是解本题关键,注意书写热化学反应方程式时,方程式的计量数不同其焓变不同,难度不大.

| A. | 0.2mol•L-1•min-1 | B. | 0.6mol•L-1•min-1 | ||
| C. | 1.8mol•L-1•min-1 | D. | 3.6mol•L-1•min-1 |
| A. | 苯(硝基苯):加少量蒸馏水振荡,待分层后分液 | |
| B. | CO2(HCl、水蒸气):通过盛有碱石灰的干燥管 | |
| C. | 乙烷(乙烯):通入氢气发生加成反应 | |
| D. | 乙醇(水):加新制的生石灰,蒸馏 |
| A. | 与HCl加成生成CH3COCl | B. | 与H2O加成生成CH3COOH | ||
| C. | 与CH3COOH加成生成CH3COOCOCH3 | D. | 与CH3OH加成生成CH3COCH2OH |
| A. | Mg | B. | Al | C. | Si | D. | Cl2 |
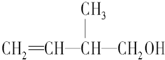
| A. | 能与金属钠反应并放出氢气 | |
| B. | 能在催化剂作用下与H2发生加成反应 | |
| C. | 能发生银镜反应 | |
| D. | 在浓H2SO4催化下能与乙酸发生酯化反应 |
 ;
; ;仅由极性键形成的非极性分子的结构式为
;仅由极性键形成的非极性分子的结构式为 ,该分子中心原子的杂化轨道类型是sp3杂化;简单氢化物的沸点最高的是H2O.
,该分子中心原子的杂化轨道类型是sp3杂化;简单氢化物的沸点最高的是H2O.
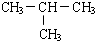 ,它的一氯取代产物有2种.
,它的一氯取代产物有2种.
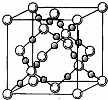 已知A、B、C、D、E五种元素的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2对成对电子.请回答下列问题:
已知A、B、C、D、E五种元素的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2对成对电子.请回答下列问题: