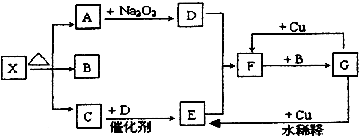
题目内容
5.能大量共存且溶液为无色透明的离子组是( )| A. | Ag+ K+ MnO4- Cl- | B. | Na+ H+ NO3- SO42- | ||
| C. | K+ Ca2+ NO3- CO32- | D. | Cu2+ Na+ Cl- SO42- |
分析 离子之间不反应生成气体、沉淀、弱电解质或发生氧化还原反应、双水解反应、络合反应的就能共存,溶液无色,说明不含有色离子,据此分析解答.
解答 解:A.MnO4-呈紫色,不符合无色条件,且Ag+ 和 Cl-生成AgCl沉淀,所以不能大量共存,故A错误;
B.这几种离子之间不反应且都是无色,所以符合条件,能大量共存,故B正确;
C.Ca2+和CO32-反应生成碳酸钙白色沉淀,所以不能大量共存,故C错误;
D.Cu2+ 呈蓝色,不符合无色条件,故D错误;
故选B.
点评 本题考查离子共存,为高频考点,侧重考查复分解反应,明确离子共存条件及离子性质是解本题关键,易错选项是A.

练习册系列答案
相关题目
16.下列离子方程式正确的是( )
| A. | 金属钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 铜粉溶于氯化铁溶液中:Cu+2Fe3+═2Fe2++Cu2+ | |
| C. | 氯气与冷氢氧化钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 向氯化铝溶液中加入过量氨水:4OH-+Al3+═AlO2-+2H2O |
13.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 2.8g铁粉在1.12L(标准状态)氯气中充分燃烧,失去的电子数为0.15NA | |
| B. | 常温下,0.1mol/LHCl溶液中所含的H+个数为0.1NA | |
| C. | 11.2L 的CO气体与0.5molN2所含的电子数相等 | |
| D. | 10gH218O中所含的中子数为5NA |
20.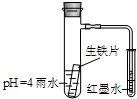 如图装置中,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片.观察:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面.以下有关解释合理的是( )
如图装置中,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片.观察:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面.以下有关解释合理的是( )
 如图装置中,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片.观察:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面.以下有关解释合理的是( )
如图装置中,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片.观察:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面.以下有关解释合理的是( )| A. | 生铁片中的碳是原电池的阳极,发生氧化反应 | |
| B. | 雨水酸性较强,生铁片仅发生析氢腐蚀 | |
| C. | 导管内液面回升时,碳极反应式为:O2+4e-+2H2O=4OH- | |
| D. | 具支试管中溶液pH逐渐减小 |
10.若NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1mol Cl2作为氧化剂得到的电子数为NA | |
| B. | 在0℃101kPa时,22.4L氢气中含有NA个氢原子 | |
| C. | NA个一氧化碳分子和0.5mol甲烷的质量比为7:4 | |
| D. | 14g 氮气中含有7NA个电子 |
17.天然水中含有细小悬浮颗粒或胶体颗粒,可用混凝剂进行净化处理,下述物质不能作为混凝剂的是( )
| A. | 碱式氯化铝 | B. | 明矾 | C. | 绿矾 | D. | 胆矾 |
14.将32g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L,则生成的NO和NO2的体积之比为( )
| A. | 1:2 | B. | 2:1 | C. | 1:1 | D. | 4:1 |