题目内容
16.下列离子方程式正确的是( )| A. | 金属钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 铜粉溶于氯化铁溶液中:Cu+2Fe3+═2Fe2++Cu2+ | |
| C. | 氯气与冷氢氧化钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 向氯化铝溶液中加入过量氨水:4OH-+Al3+═AlO2-+2H2O |
分析 A.2mol钠与水反应生成1mol氢气,离子方程式两边得失电子不相等;
B.铜与氯化铁反应生成氯化亚铁和氯化铜;
C.氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
D.氨水为弱碱,二者反应生成氢氧化铝沉淀,且一水合氨不能拆开.
解答 解:A.金属钠与水反应生成氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.铜粉溶于氯化铁溶液中,二者发生氧化还原反应,反应的离子方程式为:Cu+2Fe3+═2Fe2++Cu2+,故B正确;
C.氯气与冷氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,故C正确;
D.氯化铝溶液中加入过量氨水,反应生成氢氧化铝沉淀,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故D错误;
故选BC.
点评 本题考查了离子方程式的判断,题目难度中等,注意掌握离子方程式正误判断常用方法,如:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等).

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.下列烷烃中,一氯代物的同分异构体种数最多的是( )
| A. | 异丁烷 | B. | 2-甲基丁烷 | C. | 丙烷 | D. | 3-乙基戊烷 |
4.下面有关硅的叙述中,正确的是( )
| A. | 二氧化硅在电子工业中,是最重要的半导体材料 | |
| B. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位 | |
| C. | 硅的化学性质不活泼,在自然界中可以以游离态存在 | |
| D. | 光导纤维是以二氧化硅为主要原料制成的 |
1.下列反应的离子方程式书写错误的是( )
| A. | 醋酸跟氢氧化钠溶液反应:CH3COOH+OH-→CH3COO-+H2O | |
| B. | 铁跟稀盐酸反应:Fe+2H+→Fe2++H2↑ | |
| C. | 在硫氢化钠溶液中加入稀硫酸溶液:S2-+2H+→H2S↑ | |
| D. | 碳酸钙溶于盐酸中:CaCO3+2H+→Ca2++H2O+CO2↑ |
5.能大量共存且溶液为无色透明的离子组是( )
| A. | Ag+ K+ MnO4- Cl- | B. | Na+ H+ NO3- SO42- | ||
| C. | K+ Ca2+ NO3- CO32- | D. | Cu2+ Na+ Cl- SO42- |
6.已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;
②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;
③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色.
下列判断正确的是( )
②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;
③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色.
下列判断正确的是( )
| A. | 上述实验证明氧化性:MnO4->Cl2>Fe3+>I2 | |
| B. | 上述实验中,共有两个氧化还原反应 | |
| C. | 实验①生成的气体不能使湿润的淀粉KI试纸变蓝 | |
| D. | 实验②证明Fe2+有还原性,保存FeCl2溶液时,要向溶液中加入少量铁粉 |
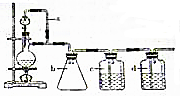 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH2CH=CH2+CO+H2$→_{△}^{催化剂}$CH3CH3CH2CHO$→_{△}^{H_{2}催化剂}$CH3CH2CH2CH2OH.
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH2CH=CH2+CO+H2$→_{△}^{催化剂}$CH3CH3CH2CHO$→_{△}^{H_{2}催化剂}$CH3CH2CH2CH2OH.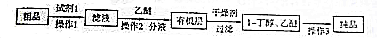
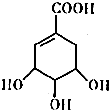 莽草酸的结构简式如图.请回答:
莽草酸的结构简式如图.请回答: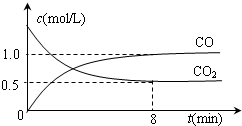 CO气体还原FeO固体可以得到Fe固体,铁的化合物具有重要的应用.
CO气体还原FeO固体可以得到Fe固体,铁的化合物具有重要的应用.