题目内容
17.天然水中含有细小悬浮颗粒或胶体颗粒,可用混凝剂进行净化处理,下述物质不能作为混凝剂的是( )| A. | 碱式氯化铝 | B. | 明矾 | C. | 绿矾 | D. | 胆矾 |
分析 凡是具有或是能生成吸附含有细小悬浮颗粒或胶体颗粒的物质都可以做然水净化混凝剂,据氢氧化铁、氢氧化铝的净水作用来回答.
解答 解:A、碱式氯化铝中的铝离子水解能得到具有净水作用的氢氧化铝,可以做天然水净化混凝剂,故A错误;
B、明矾中的铝离子水解能得到具有净水作用的氢氧化铝,可以做天然水净化混凝剂,故B错误;
C、绿矾中硫酸亚铁中的亚铁离子易被氧气氧化为铁离子,铁离子水解能得到具有净水作用的氢氧化铁,可以做天然水净化混凝剂,故C错误;
D、胆矾溶解后不具有吸附含有细小悬浮颗粒或胶体颗粒的物质的作用,不能做天然水净化混凝剂,故D正确;
故选D.
点评 本题考查学生盐的水解原理和应用知识,注意氢氧化铁、氢氧化铝的净水作用的理解是关键,难度中等.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案
相关题目
7.下列烷烃中,一氯代物的同分异构体种数最多的是( )
| A. | 异丁烷 | B. | 2-甲基丁烷 | C. | 丙烷 | D. | 3-乙基戊烷 |
5.能大量共存且溶液为无色透明的离子组是( )
| A. | Ag+ K+ MnO4- Cl- | B. | Na+ H+ NO3- SO42- | ||
| C. | K+ Ca2+ NO3- CO32- | D. | Cu2+ Na+ Cl- SO42- |
12.下列离子方程式的书写正确的是( )
| A. | 稀硫酸与Ba(OH)2溶液反应:SO42-+Ba2+═BaSO4↓ | |
| B. | 向氯化亚铁溶液中通入Cl2:Fe2++Cl2═Fe3++2Cl- | |
| C. | 铁和稀盐酸的反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 碳酸镁与稀硫酸的反应:MgCO3+2H+═Mg2++H2O+CO2↑ |
2.下列叙述正确的是( )
| A. | 电解饱和食盐水制烧碱采用离子交换膜法,可以阻止阳离子通过 | |
| B. | 在铁上镀锌时,锌棒作阳极,且电解液硫酸锌的浓度是不变的 | |
| C. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 | |
| D. | 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH |
6.已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;
②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;
③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色.
下列判断正确的是( )
②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;
③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色.
下列判断正确的是( )
| A. | 上述实验证明氧化性:MnO4->Cl2>Fe3+>I2 | |
| B. | 上述实验中,共有两个氧化还原反应 | |
| C. | 实验①生成的气体不能使湿润的淀粉KI试纸变蓝 | |
| D. | 实验②证明Fe2+有还原性,保存FeCl2溶液时,要向溶液中加入少量铁粉 |
7.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1 mol NaHSO4晶体中离子总数为3NA | |
| B. | 2.24L14CH4分子中所含中子数为0.8NA | |
| C. | 0.1L 3 mol•L-1的NH4NO3溶液中含有的NH4+数目为0.3 NA | |
| D. | 标况下,将FeSO4溶液置于空气中,被氧化的Fe2+为0.2 NA,吸收O2为1.12 L |
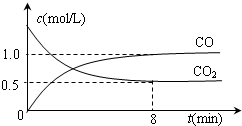 CO气体还原FeO固体可以得到Fe固体,铁的化合物具有重要的应用.
CO气体还原FeO固体可以得到Fe固体,铁的化合物具有重要的应用.