题目内容
20.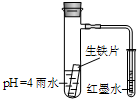 如图装置中,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片.观察:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面.以下有关解释合理的是( )
如图装置中,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片.观察:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面.以下有关解释合理的是( )| A. | 生铁片中的碳是原电池的阳极,发生氧化反应 | |
| B. | 雨水酸性较强,生铁片仅发生析氢腐蚀 | |
| C. | 导管内液面回升时,碳极反应式为:O2+4e-+2H2O=4OH- | |
| D. | 具支试管中溶液pH逐渐减小 |
分析 溶液呈酸性,生铁中含有碳和铁,酸性条件下,生铁发生析氢腐蚀生成氢气,导致具支试管内气体压强大于大气压,导管内液面下降,当溶液呈弱酸性或中性时,生铁发生吸氧腐蚀,导致具支试管中气体压强小于大气压,导管内液面回升,略高于小试管液面,据此分析解答.
解答 解:溶液呈酸性,生铁中含有碳和铁,酸性条件下,生铁发生析氢腐蚀生成氢气,导致具支试管内气体压强大于大气压,导管内液面下降,当溶液呈弱酸性或中性时,生铁发生吸氧腐蚀,导致具支试管中气体压强小于大气压,导管内液面回升,略高于小试管液面;
A.铁、碳和电解质溶液构成原电池,碳作正极,正极上得电子发生还原反应,故A错误;
B.通过以上分析知,生铁片发生析氢腐蚀和吸氧腐蚀,故B错误;
C.墨水回升时,生铁片发生吸氧腐蚀,碳极上氧气得电子生成氢氧根离子,电极反应式为:O2+2H2O+4e-═4OH-,故C正确;
D.具支试管中溶液,先呈酸性,发生析氢腐蚀时,溶液酸性逐渐减弱pH增大,当发生吸氧腐蚀时,负极上铁失电子生成亚铁离子,正极上生成氢氧根离子,亚铁离子和氢氧根离子生成氢氧化铁沉淀,溶液的pH不变,所以反应过程中,溶液的pH先增大达到一定值后不变,故D错误;
故选C.
点评 本题考查了金属的析氢腐蚀和吸氧腐蚀,明确雨水的酸碱性及生铁发生析氢腐蚀和吸氧腐蚀的条件是解本题的关键,难度不大,注意正常雨水的pH不是7而是5.6,为易错点.

练习册系列答案
相关题目
15.下列实验能达到目的是( )
| A. | 用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸 | |
| B. | 用Cu与S共热制备CuS | |
| C. | 用品红和盐酸检验Na2SO3和Na2CO3 | |
| D. | 将混有乙烯的SO2通入酸性KMnO4溶液中除去乙烯 |
5.能大量共存且溶液为无色透明的离子组是( )
| A. | Ag+ K+ MnO4- Cl- | B. | Na+ H+ NO3- SO42- | ||
| C. | K+ Ca2+ NO3- CO32- | D. | Cu2+ Na+ Cl- SO42- |
12.下列离子方程式的书写正确的是( )
| A. | 稀硫酸与Ba(OH)2溶液反应:SO42-+Ba2+═BaSO4↓ | |
| B. | 向氯化亚铁溶液中通入Cl2:Fe2++Cl2═Fe3++2Cl- | |
| C. | 铁和稀盐酸的反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 碳酸镁与稀硫酸的反应:MgCO3+2H+═Mg2++H2O+CO2↑ |
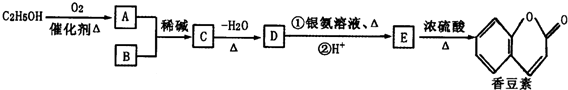
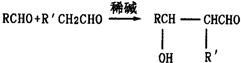 (R、R′为烃基或氢原子)
(R、R′为烃基或氢原子)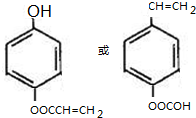 .
.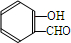 $\stackrel{NaOH}{→}$
$\stackrel{NaOH}{→}$ 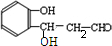 .
.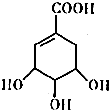 莽草酸的结构简式如图.请回答:
莽草酸的结构简式如图.请回答: CO气体还原FeO固体可以得到Fe固体,铁的化合物具有重要的应用.
CO气体还原FeO固体可以得到Fe固体,铁的化合物具有重要的应用.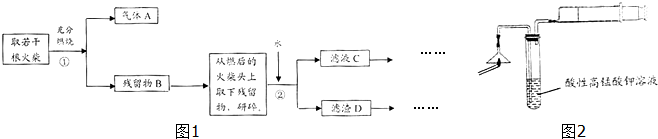
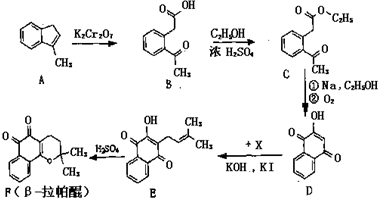
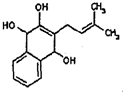
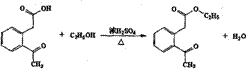 .
.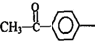 结构且能水解的所有同分异构体的结构简式:
结构且能水解的所有同分异构体的结构简式: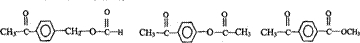 .
.