题目内容
【题目】I.现用物质的量浓度为0.100 0 mol·L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:
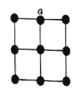
(1)从下表中选出正确选项______________

(2)某学生的操作步骤如下:
A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴部分充满溶液;
D.取标准NaOH溶液注入碱式滴定管至“0”刻度以上 2~3 mL;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是____→___→___→___→A→___(用字母序号填写)______________。判断到达滴定终点的实验现象是_____________________________________。
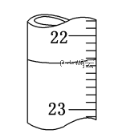
(3)若滴定达终点时,滴定管中的液面如上图所示,正确的读数为__________
A.22.30 mL B.23.65 mL
C.22.35 mL D.23.70 mL
(4)由于错误操作,使得上述所测盐酸溶液的浓度偏高的是________(填字母)。
A.中和滴定达终点时俯视滴定管内液面读数
B.酸式滴定管用蒸馏水洗净后立即取用25.00 mL待测酸溶液注入锥形瓶进行滴定
C.碱式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.用酸式滴定管量取待测盐酸时,取液前有气泡,取液后无气泡
(5)滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 20.00 | 1.02 | 21.03 |
2 | 20.00 | 2.00 | 21.99 |
3 | 20.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.1010 mol/L,则该样品的浓度是________________ 。
【答案】D B 、D 、 C 、 E 、F 滴入最后一滴氢氧化钠溶液后,溶液由无色变为粉红色且半分钟内不变色 C C 0.1010 mol/L
【解析】
(1)根据酸碱滴定管的构造选择;
(2)操作的步骤是选择滴定管,然后洗涤、装液、使尖嘴充满溶液、固定在滴定台上,然后调节液面记下读数,再取待测液于锥形瓶,然后加入指示剂进行滴定;
(3)滴定管的刻度自上而下逐渐增大;
(4)由c测=![]() ,由于c标、V测均为定植,所以c测的大小取决于V标的大小,即V标:偏大或偏小,则c测偏大或偏小;
,由于c标、V测均为定植,所以c测的大小取决于V标的大小,即V标:偏大或偏小,则c测偏大或偏小;
(5)根据c测=![]() 计算。
计算。
(1)现用物质的量浓度为0.100 0 mol·L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,则盐酸装在锥形瓶中,氢氧化钠溶液装在碱式滴定管中进行滴定,选用乙,指示剂选用酚酞,答案选D;
(2)操作的步骤是选择滴定管,然后洗涤、装液、使尖嘴充满溶液、固定在滴定台上,然后调节液面记下读数,再取待测液于锥形瓶,然后加入指示剂进行滴定,正确操作步骤的顺序是B→D→C→E→A→F。判断到达滴定终点的实验现象是滴入最后一滴氢氧化钠溶液后,溶液由无色变为粉红色且半分钟内不变色;
(3)氢氧化钠溶液应该用碱式滴定管量取。由于滴定管的刻度自上而下逐渐增大,所以根据装置图可知,此时的读数是22.35 mL,答案选C;
(4)A.中和滴定达终点时俯视滴定管内液面读数,读数偏小,测得溶液浓度偏低;
B.酸式滴定管用蒸馏水洗净后立即取用25.00 mL待测酸溶液注入锥形瓶进行滴定,则待测液浓度偏低,消耗的标准碱液体积偏小,测得溶液浓度偏低;
C.碱式滴定管用蒸馏水洗净后立即装标准溶液来滴定,则标准溶液浓度偏低,滴定消耗的标准液体积偏大,测得溶液浓度偏高;
D.用酸式滴定管量取待测盐酸时,取液前有气泡,取液后无气泡,则所取盐酸的体积偏小,消耗标准液的体积偏小,测得溶液浓度偏低;
答案选C;
(5)三次测定的体积分别为20.01 mL、19.99 mL、20.00 mL,平均消耗体积为20.00 mL,
若NaOH标准溶液的浓度为0.1010 mol/L,则该样品的浓度是![]() 。
。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案