题目内容
【题目】一定条件下,CH3COONa溶液存在水解平衡:CH3COO-+H2O![]() CH3COOH+OH-,下列说法正确的是( )
CH3COOH+OH-,下列说法正确的是( )
A. 稀释溶液,溶液的pH增大 B. 加入少量NaOH固体,c(CH3COO-)减小
C. 温度升高,c(CH3COO-)增大 D. 加入少量FeCl3固体,c(CH3COO-)减小
【答案】D
【解析】
考查影响盐类水解平衡的因素,应用平衡移动原理分析判断。
A项:稀释时水解平衡右移,OH-物质的量变大。但溶液体积变大,OH-浓度变小,溶液的pH减小。A项错误;
B项:加入少量NaOH固体,OH-浓度增大,平衡左移, c(CH3COO-)增大。B项错误;
C项:因水解吸热,升高温度,平衡右移, c(CH3COO-)减小。C项错误;
D项:加入少量FeCl3固体时,Fe3+结合OH-使平衡右移,c(CH3COO-)减小。D项正确。
本题选D。

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】I.现用物质的量浓度为0.100 0 mol·L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:
(1)从下表中选出正确选项______________


(2)某学生的操作步骤如下:
A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴部分充满溶液;
D.取标准NaOH溶液注入碱式滴定管至“0”刻度以上 2~3 mL;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是____→___→___→___→A→___(用字母序号填写)______________。判断到达滴定终点的实验现象是_____________________________________。
(3)若滴定达终点时,滴定管中的液面如上图所示,正确的读数为__________
A.22.30 mL B.23.65 mL
C.22.35 mL D.23.70 mL
(4)由于错误操作,使得上述所测盐酸溶液的浓度偏高的是________(填字母)。
A.中和滴定达终点时俯视滴定管内液面读数
B.酸式滴定管用蒸馏水洗净后立即取用25.00 mL待测酸溶液注入锥形瓶进行滴定
C.碱式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.用酸式滴定管量取待测盐酸时,取液前有气泡,取液后无气泡
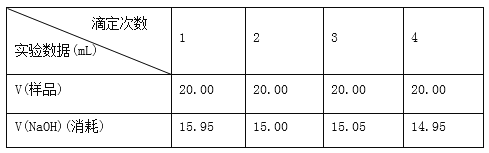
(5)滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 20.00 | 1.02 | 21.03 |
2 | 20.00 | 2.00 | 21.99 |
3 | 20.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.1010 mol/L,则该样品的浓度是________________ 。
【题目】(1)汽车尾气中的CO、NOx、碳氢化合物是大气污染物。使用稀土等催化剂能将CO、NO转化成无毒物质。
已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
2C(s)+O2(g)=2CO(g) △H2=-221 kJ/mol
C(s)+O2(g)=CO2(g) △H3=-393.5 kJ/mol
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式为: _______________。
(2)工业上可以在恒容密闭容器中采用下列反应制备甲醇:CO(g)+2H2(g)![]() CH3OH(g),下表所列数据为该反应在不同温度下的化学平衡常数:
CH3OH(g),下表所列数据为该反应在不同温度下的化学平衡常数:
温度/℃ | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
①反应的平衡常数表达式为K=______。由上表数据判断,该反应的△H_______ 0(填“>”、“=”或“<”)。升高温度,正反应速率________填“增大”、“减小”或“不变”)。
②某温度下,将2molCO和6molH2充入一个容积为2L的密闭容器中,达到平衡时c(H2)=1.4mol/L,则CO的转化率为_______,此时的温度为_______。
③欲提高CO的转化率,可采取的措施是______ 。(填序号)
A.升温 B.加入更高效的催化剂 C.恒容条件下充入CO
D.恒容条件下充入H2 E.恒容条件下充入氦气 F.及时移走CH3OH
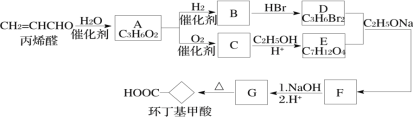
【题目】“结晶玫瑰”是具有强烈玫瑰香气的结晶型固体香料,在香料和日用化工产品中具有广阔的应用价值。其化学名称为“乙酸三氯甲基苯甲酯”,目前国内工业上主要使用以下路径来合成结晶玫瑰:
I.由苯甲醛和氯仿合成三氯甲基苯基甲醇。
Ⅱ.三氯甲基苯基甲醇与乙酸酐发生乙酰化反应制得“结晶政瑰”。

已知:
三氯甲基苯基甲醇 | 相对分子质量:225.5。无色液体。不溶于水,密度比水大,溶于乙醇 |
乙酸酐 | 无色液体。与水反应生成乙酸,溶于乙醇 |
“结晶玫瑰” | 相对分子质量:267.5。白色晶体。熔点:88℃。不溶于水,溶于乙醇 |
具体实验步骤如下:
I.由苯甲醛和氯仿合成三氯甲基苯基甲醇。
步骤一:装置如图所示。依次将苯甲醛、氯仿加入三颈烧瓶中,仪器A中加入KOH和助溶剂。滴加A中试剂并搅拌,开始反应并控制在一定温度下进行。

步骤二:反应结束后,将混合物依次用5%的盐酸、蒸馏水洗涤。
步骤三:将洗涤后的混合物蒸馏,除去其他有机杂质,加无水琉酸镁,过滤。滤液即为粗制三氯甲基萃基甲醇。
Ⅱ.三氯甲基苯基甲醇与乙酸酐发生乙酰化反应制得“结晶玫瑰”。
步骤四:向另一三颈瓶中加入制备的三氯甲基苯基甲醇、乙酸酐,并加入少量浓硫酸催化反应,加热控制反应温度在90℃~110℃之间。
步骤五:反应完毕后,将反应液倒入冰水中,冷却结晶获得“结晶玫瑰”。
请回答下列问题:
(1)仪器A的名称是_________。实验装置B中,冷凝水应从_____口进(填“a”或“b”)。
(2)步骤二中,用5%的盐酸洗涤的主要目的是___________。在洗涤、分液操作中,应充分振荡,然后静置,待分层后有机层应___________ (填序号)。
A.直接从上口倒出
B.先将水层从上口倒出,再将有机层从下口放出
C.直接从下口放出
D.先将水层从下口放出,再将有机层从下口放出
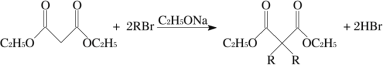
(3)步骤三中,加入无水硫酸镁的目的是___________。若未加入无水硫酸镁,直接将蒸馏所得物质进行后续反应,会使“结晶玫瑰”的产率偏______(填“高”或“低”),其原因是___________ (利用平衡移动原理解释)。(已知Ⅱ的具体反应如图所示)

(4)步骤四中,加料时,应先加入三氯甲基苯基甲醇和乙酸酐,然后慢慢加入浓硫酸并搅拌,主要是为了__________。加热反应时,为较好的控制温度,最适宜的加热方式为_____(填“水浴加热”或“油浴加热”)。
(5)22.55g三氟甲基苯基甲醇与足量乙酸酐充分反应得到结晶玫瑰21.40g,则产率是_____。