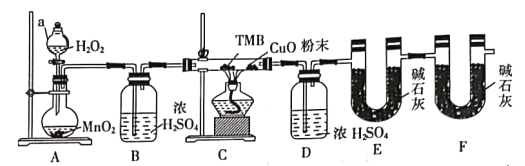
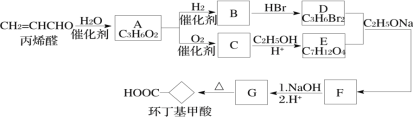
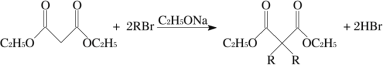
题目内容
【题目】(1)49 g H2SO4的物质的量是________;1.5 mol H2SO4的质量是________,其中含有_______mol SO42-,______mol H,含有______g O。
(2)用14.2 g无水硫酸钠配制成500 mL溶液,其物质的量浓度为________mol/L。
(3)若从中取出50 mL,其物质的量浓度为_______ mol/L;溶质的质量为________ g。
【答案】0.5mol 147g 1.5 3 96 0.2 0.2 1.42
【解析】
(1)结合m=nM、N=nNA及分子构成计算;
(2)根据n=![]() 和c=
和c=![]() 来计算;
来计算;
(3)溶液是均一稳定的,取出一部分溶液后,溶液的浓度不变,根据n=cV和m=nM来计算。
(1)49 g H2SO4的物质的量是![]() =0.5mol;1.5 mol H2SO4的质量是1.5mol×98g/mol=147g,其中含有1.5 mol SO42-,含氢原子的物质的量是1.5mol×2=3mol,含有氧原子质量是1.5mol×4×16g/mol=96g;
=0.5mol;1.5 mol H2SO4的质量是1.5mol×98g/mol=147g,其中含有1.5 mol SO42-,含氢原子的物质的量是1.5mol×2=3mol,含有氧原子质量是1.5mol×4×16g/mol=96g;
(2)14.2g无水硫酸钠的物质的量n=![]() =
=![]() =0.1mol,溶液的浓度c=
=0.1mol,溶液的浓度c=![]() =
=![]() =0.2mol/L;
=0.2mol/L;
(2)溶液是均一稳定的,取出一部分溶液后,溶液的浓度不变,故取出50 mL,其物质的量浓度为0.2 mol/L;物质的量n=cV=0.2mol/L×0.05L=0.01mol,溶质的质量m=nM=0.01mol×142g/mol=1.42g。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】I.现用物质的量浓度为0.100 0 mol·L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:
(1)从下表中选出正确选项______________


(2)某学生的操作步骤如下:
A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴部分充满溶液;
D.取标准NaOH溶液注入碱式滴定管至“0”刻度以上 2~3 mL;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是____→___→___→___→A→___(用字母序号填写)______________。判断到达滴定终点的实验现象是_____________________________________。
(3)若滴定达终点时,滴定管中的液面如上图所示,正确的读数为__________
A.22.30 mL B.23.65 mL
C.22.35 mL D.23.70 mL
(4)由于错误操作,使得上述所测盐酸溶液的浓度偏高的是________(填字母)。
A.中和滴定达终点时俯视滴定管内液面读数
B.酸式滴定管用蒸馏水洗净后立即取用25.00 mL待测酸溶液注入锥形瓶进行滴定
C.碱式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.用酸式滴定管量取待测盐酸时,取液前有气泡,取液后无气泡
(5)滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 20.00 | 1.02 | 21.03 |
2 | 20.00 | 2.00 | 21.99 |
3 | 20.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.1010 mol/L,则该样品的浓度是________________ 。