题目内容
【题目】在高中阶段化学学科中所涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和难溶电解质溶解平衡四种,均符合勒夏特列原理,它们在工农业生产中都有广泛的应用。请回答下列问题:

Ⅰ:(1)工业生产尿素的原理是以![]() 和
和![]() 为原料合成尿素
为原料合成尿素![]() ,反应的化学方程式为:
,反应的化学方程式为:![]() 。
。
①已知该反应的平衡常数![]() ,则该反应的
,则该反应的![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
②一定温度和压强下,若原料气中的![]() 和
和![]() 的物质的量之比
的物质的量之比![]() 氨碳比
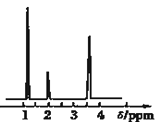
氨碳比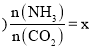 ,图1是氨碳比
,图1是氨碳比![]() 与
与![]() 平衡转化率
平衡转化率![]() 的关系,
的关系,![]() 随着x增大的原因是______;B点处,
随着x增大的原因是______;B点处,![]() 的体积分数为______
的体积分数为______![]() 保留小数点后一位
保留小数点后一位![]() 。
。
③取一定量的![]() 和
和![]() 放在一个带活塞的密闭真空容器中在一定温度下反应达平衡,若在恒温、恒容下充入气体He,
放在一个带活塞的密闭真空容器中在一定温度下反应达平衡,若在恒温、恒容下充入气体He,![]() 的质量______
的质量______![]() 填“增加”、“减小”或“不变”
填“增加”、“减小”或“不变”![]() 。
。
Ⅱ:(1)某温度下,纯水中![]() ,该温度下,
,该温度下,![]() NaOH溶液与
NaOH溶液与![]() HCl溶液等体积混合
HCl溶液等体积混合![]() 不考虑溶液体积变化
不考虑溶液体积变化![]() 后,溶液的
后,溶液的![]() ______。
______。
(2)向100mL![]()
![]() 的溶液中加入
的溶液中加入![]()
![]() 固体,溶液pH增大,主要原因是
固体,溶液pH增大,主要原因是![]() 请用学过的平衡理论解释
请用学过的平衡理论解释![]() ______;已知该混合溶液中
______;已知该混合溶液中![]() ,则
,则![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 。
。
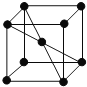
Ⅲ:(1)图2为某温度下,![]() 、
、![]() 、
、![]() 分别在溶液中达到沉淀溶解平衡后,溶液的
分别在溶液中达到沉淀溶解平衡后,溶液的![]() 浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是______
浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是______![]() 填化学式
填化学式![]() 。
。
(2)向新生成的ZnS浊液中滴入足量含相同浓度的![]() 、
、![]() 的溶液,振荡后,ZnS沉淀最终会转化为______
的溶液,振荡后,ZnS沉淀最终会转化为______![]() 填化学式
填化学式![]() 沉淀。
沉淀。
【答案】![]()
![]() 增大,平衡正向移动,
增大,平衡正向移动,![]() 转化率增大
转化率增大 ![]() 不变 13 醋酸溶液中存在电离平衡:
不变 13 醋酸溶液中存在电离平衡:![]() ,当加入
,当加入![]() 固体时,
固体时,![]() 浓度增大,使CH3COOH电离平衡逆向移动,
浓度增大,使CH3COOH电离平衡逆向移动,![]() 浓度降低,故pH增大
浓度降低,故pH增大 ![]() FeS PbS
FeS PbS
【解析】
Ⅰ.①依据平衡常数随温度变化分析判断反应吸热放热;
②增大反应物浓度,平衡正向进行;依据x含义和图象数据分析结合化学方程式换算氨气转化率;
③恒温恒容条件下,充入稀有气体,反应体系中各组分的浓度不变,平衡不移动;
Ⅱ.(1)纯水电离生成的![]() ,
,![]() ,先计算出过量的
,先计算出过量的![]() ,再结合Kw计算
,再结合Kw计算![]() ,得出反应后的溶液的pH;
,得出反应后的溶液的pH;
(2)存在![]() 电离平衡,氢离子浓度减小则pH增大;该混合溶液中
电离平衡,氢离子浓度减小则pH增大;该混合溶液中![]() ,则水解小于电离;
,则水解小于电离;
Ⅲ.(1)根据图2判断出![]() 、
、![]() 、
、![]() 的溶度积、溶解度大小,溶解度越大,加入盐酸后先溶解;
的溶度积、溶解度大小,溶解度越大,加入盐酸后先溶解;
(2)根据![]() 、
、![]() 、
、![]() 的溶解度大小及难溶物溶解平衡判断沉淀转化情况。
的溶解度大小及难溶物溶解平衡判断沉淀转化情况。
Ⅰ:①平衡常数随温度升高减小,说明正反应为放热反应,![]() ,故答案为:
,故答案为:![]() ;
;
②![]() ,图象分析判断,增大氨气浓度平衡正向进行;B点处
,图象分析判断,增大氨气浓度平衡正向进行;B点处![]() ,原料气中的
,原料气中的![]() 和
和![]() 的物质的量之比为4,二氧化碳转化率为
的物质的量之比为4,二氧化碳转化率为![]() ,假设氨气为4mol,二氧化碳为1mol,则反应的二氧化碳为
,假设氨气为4mol,二氧化碳为1mol,则反应的二氧化碳为![]() ,依据化学方程式
,依据化学方程式![]() 反应消耗的氨气为1mol,反应后气体总物质的量为:
反应消耗的氨气为1mol,反应后气体总物质的量为:![]() ,B点时
,B点时![]() 的体积分数为:
的体积分数为:![]() ,故答案为:
,故答案为:![]() 增大,平衡正向移动,
增大,平衡正向移动,![]() 转化率增大;
转化率增大;![]() ;
;
③达到平衡时,在恒温恒容条件下充入稀有气体,由于各组分的浓度没有变化,则化学平衡不会移动,![]() 的质量不变,故答案为:不变;
的质量不变,故答案为:不变;
Ⅱ.(1)纯水电离生成的![]() ,
,![]() ,过量的
,过量的![]() ,由该温度下的Kw可知,
,由该温度下的Kw可知,![]() ,所以
,所以![]() ,故答案为:13;
,故答案为:13;
(2)存在![]() 电离平衡,加入
电离平衡,加入![]() 固体,
固体,![]() 增大,则平衡逆向移动,抑制醋酸电离,溶液氢离子浓度减小则pH增大;该混合溶液中
增大,则平衡逆向移动,抑制醋酸电离,溶液氢离子浓度减小则pH增大;该混合溶液中![]() ,则醋酸根离子的水解程度小于其电离程度,所以
,则醋酸根离子的水解程度小于其电离程度,所以![]() ,
,
故答案为:醋酸溶液中存在电离平衡:![]() ,当加入
,当加入![]() 固体时,
固体时,![]() 浓度增大,使CH3COOH电离平衡逆向移动,
浓度增大,使CH3COOH电离平衡逆向移动,![]() 浓度降低,故pH增大;
浓度降低,故pH增大;![]() ;
;
Ⅲ.(1)根据图2可知,![]() 、
、![]() 、
、![]() 的溶度积大小关系为:
的溶度积大小关系为:![]() ,则溶解度
,则溶解度![]() ,如果向三种沉淀中加盐酸,最先溶解的是溶解度最大的FeS,故答案为:FeS;
,如果向三种沉淀中加盐酸,最先溶解的是溶解度最大的FeS,故答案为:FeS;
(2)向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、![]() 的溶液,由于
的溶液,由于![]() ,溶解度
,溶解度![]() ,则振荡后,ZnS沉淀会转化为更难溶的PbS,故答案为:PbS。
,则振荡后,ZnS沉淀会转化为更难溶的PbS,故答案为:PbS。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案