题目内容
【题目】已知A为周期表中原子半径最小的元素,B、C、D均为第二周期元素,其中B、C、D的电负性:![]() ,第一电离能:
,第一电离能:![]() ,且C无空轨道;E与A同主族,与F、G同周期,F为短周期金属元素,其单质既可以与酸又可以与碱反应放出氢气。G的电子最外层中没有空轨道,且成对电子所占有的轨道数是未成对电子所占轨道数的3倍。
,且C无空轨道;E与A同主族,与F、G同周期,F为短周期金属元素,其单质既可以与酸又可以与碱反应放出氢气。G的电子最外层中没有空轨道,且成对电子所占有的轨道数是未成对电子所占轨道数的3倍。
(1)![]() 分子中的中心原子是 ______;
分子中的中心原子是 ______;![]() 离子中B原子的杂化方式为 ______。
离子中B原子的杂化方式为 ______。
(2)![]() 的电子式是 ______,它与
的电子式是 ______,它与![]() 按物质的量之比为1:1混合后投入水中,所发生反应的化学方程式为 ______ 。
按物质的量之比为1:1混合后投入水中,所发生反应的化学方程式为 ______ 。
(3)![]() 溶液中,阴阳离子浓度由小到大的关系式是 ______ ,若用F单质为电极材料,电解此溶液时,则阳极的发生的电极反应式为 ______。
溶液中,阴阳离子浓度由小到大的关系式是 ______ ,若用F单质为电极材料,电解此溶液时,则阳极的发生的电极反应式为 ______。
(4)一定量的![]() 、
、![]() 、CD混合气体投入水中恰好被完全吸收,则混合气体中C、D原子的个数比为 ______ 。
、CD混合气体投入水中恰好被完全吸收,则混合气体中C、D原子的个数比为 ______ 。
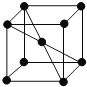
(5)E单质的晶胞如图,其堆积模型是 ______ ,配位数是 ______。
(6)工业上冶炼F的单质时,常用![]() 为原料而不用
为原料而不用![]() 作原料的原因是 ______。
作原料的原因是 ______。
【答案】N sp ![]()
![]()
![]()
![]() 5:2 体心立方密堆积 8
5:2 体心立方密堆积 8 ![]() 是共价化合物,属于分子晶体,加热会升华,熔融不导电,不能用于电解,而
是共价化合物,属于分子晶体,加热会升华,熔融不导电,不能用于电解,而![]() 是离子化合物,熔融能导电
是离子化合物,熔融能导电
【解析】
A为周期表中原子半径最小的元素,则A为H元素;B、C、D均为第二周期元素,其中B、C、D的电负性:![]() ,第一电离能:
,第一电离能:![]() ,且C无空轨道,C只能处于VA族,故C为N元素,D为O元素;结合问题(3)中为
,且C无空轨道,C只能处于VA族,故C为N元素,D为O元素;结合问题(3)中为![]() ,B的化合价为
,B的化合价为![]() ,故B为碳元素;F为短周期金属元素,其单质既可以与酸又可以与碱反应放出
,故B为碳元素;F为短周期金属元素,其单质既可以与酸又可以与碱反应放出![]() ,则F为Al;E与A同主族,与F、G同周期,即处于第三周期,故E为Na;G的电子最外层中没有空轨道,且成对电子所占有的轨道数是未成对电子所占轨道数的3倍,核外电子排布为
,则F为Al;E与A同主族,与F、G同周期,即处于第三周期,故E为Na;G的电子最外层中没有空轨道,且成对电子所占有的轨道数是未成对电子所占轨道数的3倍,核外电子排布为![]() ,故G为Cl,据此解答。
,故G为Cl,据此解答。
(1)N2O与![]() 分子是等电子体,二氧化碳和N2O分子具有相似的结构,且
分子是等电子体,二氧化碳和N2O分子具有相似的结构,且![]() 分子中氧原子只与一个氮原子相连,所以N2O的电子式为:
分子中氧原子只与一个氮原子相连,所以N2O的电子式为:![]() ,
,![]() 分子中的中心原子是N;
分子中的中心原子是N;![]() 离子中C原子之间形成碳碳三键,每个C原子有1对孤对电子,故C原子杂化轨道数目为2,采取sp杂化,故答案为:N;sp;
离子中C原子之间形成碳碳三键,每个C原子有1对孤对电子,故C原子杂化轨道数目为2,采取sp杂化,故答案为:N;sp;
(2)![]() 的电子式是
的电子式是![]() ,它与
,它与![]() 按物质的量之比为1:1混合后投入水中,过氧化钠与水反应生成氢氧化钠与氧气,氢氧化钠与氧化铝反应生成偏铝酸钠与水,得到氢氧化钠与氧化铝恰好反应,所发生反应的化学方程式为:
按物质的量之比为1:1混合后投入水中,过氧化钠与水反应生成氢氧化钠与氧气,氢氧化钠与氧化铝反应生成偏铝酸钠与水,得到氢氧化钠与氧化铝恰好反应,所发生反应的化学方程式为:![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(3)![]() 溶液中,
溶液中,![]() 的水解程度大于电离程度,溶液呈碱性,溶液中氢离子源于水的电离及
的水解程度大于电离程度,溶液呈碱性,溶液中氢离子源于水的电离及![]() 的电离,故溶液中阴阳离子浓度由大到小的关系式是:
的电离,故溶液中阴阳离子浓度由大到小的关系式是:![]() ,若用Al单质为电极材料,电解
,若用Al单质为电极材料,电解![]() 溶液,阳极发生氧化反应,Al放电得到
溶液,阳极发生氧化反应,Al放电得到![]() ,
,![]() 与溶液中
与溶液中![]() 发生水解反应生成
发生水解反应生成![]() 、
、![]() ,则阳极的发生的电极反应式为:
,则阳极的发生的电极反应式为:![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(4)一定量的![]() 、
、![]() 、NO混合气体投入水中恰好被完全吸收,发生化合反应生成
、NO混合气体投入水中恰好被完全吸收,发生化合反应生成![]() ,H原子来源于水,
,H原子来源于水,![]() 可以改写为
可以改写为![]() ·
·![]() ,则混合气体中N、O原子的个数比为1:
,则混合气体中N、O原子的个数比为1:![]() :2,故答案为:5:2;
:2,故答案为:5:2;
(5)钠单质的晶胞如图 ,其堆积模型是体心立方密堆积,配位数是8,故答案为:体心立方密堆积;8;
,其堆积模型是体心立方密堆积,配位数是8,故答案为:体心立方密堆积;8;
(6)![]() 是共价化合物,属于分子晶体,加热会升华,熔融不导电,不能用于电解,而
是共价化合物,属于分子晶体,加热会升华,熔融不导电,不能用于电解,而![]() 是离子化合物,熔融能导电,因此常用
是离子化合物,熔融能导电,因此常用![]() 为原料而不用
为原料而不用![]() 作原料,故答案为:
作原料,故答案为:![]() 是共价化合物,属于分子晶体,加热会升华,熔融不导电,不能用于电解,而
是共价化合物,属于分子晶体,加热会升华,熔融不导电,不能用于电解,而![]() 是离子化合物,熔融能导电。
是离子化合物,熔融能导电。

【题目】在药物制剂中,抗氧剂与被保护的药物在与![]() 发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。
发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。![]() 、
、![]() 和
和![]() 是三种常用的抗氧剂。下列说法中,不正确的是
是三种常用的抗氧剂。下列说法中,不正确的是
已知:![]() 溶于水发生反应:
溶于水发生反应:![]()
实验用品 | 实验操作和现象 |
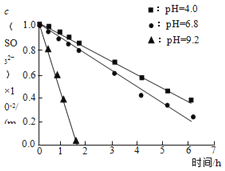
① ② ③ | 实验1:溶液①使紫色石蕊溶液变蓝,溶液②使之变红。 实验2:溶液①与 实验3:调溶液①②③的pH相同,保持体系中 |
A.![]() 溶液显碱性,原因是:
溶液显碱性,原因是:![]()
B.![]() 溶液中
溶液中![]() 的电离程度大于水解程度
的电离程度大于水解程度
C.实验2说明,![]() 在
在![]() 时抗氧性最强
时抗氧性最强
D.实验3中,三种溶液在pH相同时起抗氧作用的微粒种类和浓度相同,因此反应速率相同