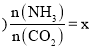题目内容
【题目】在生产和生活中金属腐蚀难以避免。对图a和图b的分析合理的是
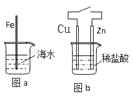
A.图a,负极上发生的反应是:O2+4e+2H2O → 4OH-
B.图b,接通开关后溶液中的H+向正极移动
C.图a,插入海水中的铁棒,越靠近底端腐蚀越严重
D.图b,接通开关后Zn腐蚀速率增大,Zn上放出气体的速率也增大
【答案】B
【解析】
A、根据图a知,水中溶解了氧气,碳、铁和水构成了原电池,负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-=Fe2+,故A错误;
B、原电池放电时,阳离子流向正极,所以溶液中的H+向正极移动,故B正确;
C、插入海水中的铁棒,在液面与空气的交界处腐蚀越严重,液面以下缺少氧气,腐蚀不严重,液面以上,缺少水,腐蚀也不严重,故C错误;
D、该原电池放电时,正极上氢离子得电子发生还原反应形成氢气,Zn腐蚀速率增大,铜上放出气体的速率也增大,故D错误;
答案选B。

【题目】下列实验方案能达到相应实验目的的是
选项 | 实验目的 | 实验方案 |
A | 检验蔗糖水解生成葡萄糖 | 取适量蔗糖溶于盛有蒸馏水的试管中,滴入稀硫酸加热一段时间,冷却,滴入新制氢氧化铜悬浊液,加热至沸腾,观察有无砖红色沉淀 |
B | 实验室制备氢氧化铁胶体 | 向盛有25mL蒸馏水的烧杯中滴入5-6滴氯化铁饱和溶液,加热煮沸至溶液呈红褐色,停止加热 |
C | 比较AgCl、AgI的Ksp大小 | 向盛有10滴0.1mol/LAgNO3 溶液的试管中滴加0.1mol/LNaCl溶液至不再有沉淀生成,再滴加0.1mol/lKI溶液 |
D | 比较Mg、Al的金属性强弱 | 用导线连接镁和铝片,插入盛有氢氧化钠溶液的烧杯中,观察气泡 |
A. A B. B C. C D. D
【题目】工业上可利用CO或CO2来生产燃料甲醇。
I.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:
化学反应 | 平衡 常数 | 温度/℃ | ||
500 | 700 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.34 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 1.70 | 2.52 |
③3H2(g)+CO2(g) | K3 | |||
请回答下列问题:
(1)反应②是________(填“吸热”或“放热”)反应。
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=__________(用K1、K2表示)。
II.CO使其在一定条件下和H2反应制备甲醇,请根据图示回答下列问题:
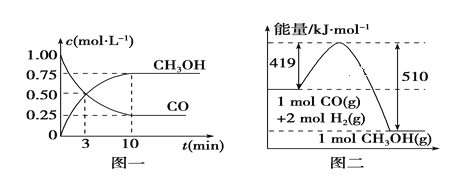
(1)写出制备甲醇的热化学方程式:__________________________________________
(2)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=______________。
(3)某温度下,在一体积不变的密闭容器中充入2.5molCO、7.5molH2,达到平衡吋测得CO的转化率为90%,此时容器内的压强是起始的___________倍。